
【题目】硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4SO3)、硫代硫酸(H2S2O3)等等,其中硫酸最为重要,在工业上有广泛的应用.在实验室,浓硫酸是常用的干燥剂.完成下列计算:
(1)焦硫酸(H2SO4 . SO3)溶于水,其中的SO3都转化为硫酸.若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为mol/L.
(2)若以浓硫酸吸水后生成H2SO4 . H2O计算,250g质量分数为98%的硫酸能吸收多少g水?
(3)硫铁矿是工业上制硫酸的主要原料.硫铁矿氧化焙烧的化学反应如下:3FeS2+8O2→Fe3O4+6SO2 4FeS2+11O2→2Fe2O3+8SO2
若48molFeS2完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量之比.
(4)用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法.硫化氢体积分数为0.84的混合气体(H2S、H2O、N2)在空气中完全燃烧,若空气过量77%,计算产物气体中SO2体积分数(水是气体).
已知空气组成:N2体积分数0.79、O2体积分数0.21.
【答案】
(1)1.25
(2)解:n(H2SO4H2O)=n(H2SO4)= ![]() =2.5mol,所以吸收水的质量为:2.5mol×116g/mol﹣250g=40g,
=2.5mol,所以吸收水的质量为:2.5mol×116g/mol﹣250g=40g,
答:250g质量分数为98%的硫酸能吸收40g水
(3)解:2934.4L氧气的物质的量为 ![]() =131mol,设Fe3O4与Fe2O3物质的量分别为amol,bmol,则
=131mol,设Fe3O4与Fe2O3物质的量分别为amol,bmol,则 ![]() ,解得:
,解得: ![]() ,所以Fe3O4与Fe2O3物质的量之比4:18=2:9,
,所以Fe3O4与Fe2O3物质的量之比4:18=2:9,
答:反应产物中Fe3O4与Fe2O3物质的量之比2:9
(4)解:设混合所体为1体积,则硫化氢为0.84体积,
由2H2S+3O2 ![]() 2SO2+2H2O,
2SO2+2H2O,
2 3 2 2
0.84 1.26 0.84 0.84
所以反应消耗的空气为: ![]() =6,而空气过量77%,所以一共所需空气为:6×1.77=10.62体积,所以φ(SO2)=
=6,而空气过量77%,所以一共所需空气为:6×1.77=10.62体积,所以φ(SO2)= ![]() =0.075,
=0.075,
答:产物气体中SO2体积分数为0.075
【解析】解:(1)n(H2SO4 . SO3)= ![]() =2.5mol,每个焦硫酸分子可以吸水后成为2个硫酸分子,所以C=
=2.5mol,每个焦硫酸分子可以吸水后成为2个硫酸分子,所以C= ![]() =
= ![]() =1.25mol/L, 所以答案是:1.25;
=1.25mol/L, 所以答案是:1.25;


科目:高中化学 来源: 题型:
【题目】下列关于硫及其化合物说法错误的是( )
A.实验室常将硫磺撒在汞的表面以除去不慎洒落的汞
B.葡萄酒中添加适量SO2可以起到抗氧化的作用
C.硫酸钡可用作消化系统X射线检查的内服药剂
D.“石胆……浅碧色,烧之变白色者真”所描述的“石胆”是指FeSO4·7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.05mol SO2(g)和0.03mol O2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)2SO3(g),在一定条件下达到平衡,测得c(SO3)=0.04molL﹣1 . 以下表述正确的是( )
A.该条件下反应的平衡常数为1.6×103
B.通常情况下,该反应一定能自发进行
C.题给条件下,O2的转化率是20%
D.当体系中SO2和SO3的速率之比是1:1时,则该反应达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大.有关信息如表:
X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
Y | 地壳中含量居第一位 |
Z | 短周期中其原子半径最大 |
Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备其单质 |
M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
(1)X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,请写出该气态氢化物的电子式 .
(2)已知37Rb和53I都位于第五周期,分别与Z和M同一主族.下列有关说法正确的是(填序号).
A.原子半径:Rb>I
B.RbM中含有共价键
C.气态氢化物热稳定性:M>I
D.Rb、Q,M的最高价氧化物对应的水化物可以两两发生反应
(3)化合物QX导热性好,热膨胀系数小,是良好的耐热冲击材料.有关化合物QX的制备及化学性质如下(所有热量数据均已折合为25℃、101.3 kPa条件下的数值).①可用Q和X的单质在800~1 000℃制得,每生成1 mol QX,吸收a kJ的热量.
②可用Q的氧化物、焦炭和X的单质在1 600~1 750℃生成QX,每消耗18 g碳生成1 mol QX,吸收b kJ的热量.
请根据上述信息写出在理论上Q的氧化物跟焦炭反应生成Q单质和CO的热化学方程式 .
(4)X、Y组成的一种无色气体遇空气变为红棕色.标准状况下将40 L该无色气体与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐.请写出该反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色工业废水中可能含有Na+、Mg2+、Al3+、Cu2+、Cl﹣、SO42﹣中的几种离子.
a.取0.1mL该废水于管中,加入足量的Ba(N03)溶液和稀硝酸,产生白色沉淀,充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生.
b.另取10mL该废水于管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解.生成沉淀的物质的量随加入NaOH物质的量关系如图所示.
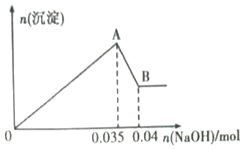
根据上述实验和图表数据:
(1)该废水中一定不含有的离子有______________(填离子符号).
(2)实验室配制100mL1molL﹣1的NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要_____________(填仪器名称).
(3)写出A→B过程中发生反应的离子方程式:_________________________.
(4)该废水中,c(Al3+)=_______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是( ) 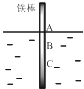
A.铁棒AB段发生反应为O2+4e﹣+2H2O=4OH﹣
B.腐蚀过程中在铁棒上会产生微电流,且方向是AB段到BC段
C.向水中加入一定量硫酸钾固体后,对铁棒的生锈速率几乎无影响
D.产生这种现象的本质原因是铁棒所处的化学环境不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.亚甲基蓝和亚甲基白在碱性条件下都不能稳定存在
B.亚甲基蓝变为亚甲基白后,通常不能再复原为亚甲基蓝
C.亚甲基白变为亚甲基蓝后,通常不能再复原为亚甲基白
D.亚甲基白不稳定,能缓慢释放出氧气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com