
分析 (1)c(NaOH)=$\frac{n}{V}$=$\frac{\frac{m}{M}}{V}$;
(2)根据转移电子守恒及电荷守恒计算溶液中c(ClO-).
解答 解:(1)c(NaOH)=$\frac{n}{V}$=$\frac{\frac{m}{M}}{V}$=$\frac{\frac{40g}{40g/mol}}{0.25L}$=4mol/L,故答案为:4;
(2)溶液中c(Cl-)=6c(ClO-),因为溶液体积相同,所以n(Cl-)=6n(ClO-),根据转移电子相等得n(Cl-)×1=n(ClO-)×1+n(ClO3-)×5,则n(ClO-)=n(ClO3-),即c(ClO-)=c(ClO3-),溶液中存在电荷守恒c(Cl-)+c(ClO-)+c(ClO3-)=8c(ClO-)=c(Na+)=4mol/L,所以c(ClO-)=0.5mol/L,
故答案为:0.5.
点评 本题考查化学方程式的有关计算,为高频考点,明确各个物理量之间的关系是解本题关键,注意转移电子守恒及电荷守恒的正确运用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1mol苯分子中含有C═C键的数目为3NA | |
| B. | 含1molNa2CO3的溶液中,阴离子总数大于NA | |
| C. | 1molFeI2与足量氯气反应时转移的电子数为2NA | |
| D. | 标准状况下,22.4L空气中含有的氧原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出的c(H+)=10-13mol/L的溶液中可能存在:HCO3-、K+、Cl- | |
| B. | 酸性溶液中可能大量存在Na+、ClO-、I- | |
| C. | pH=l的溶液中的溶液中可以大量存在:K+、I-、NO3- | |
| D. | NH4Fe(SO4)2的溶液中一定可以存在:H+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
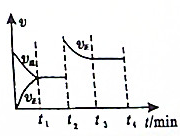
| A. | t2可能是升高温度 | |
| B. | t1时刻Y的体积分数可能比t3时刻Y的体积分数小 | |
| C. | t1时刻X的浓度可能比t3时刻X的浓度大 | |
| D. | t1时的平衡是从逆反应方向建立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、天然气和石油是纯净物 | |
| B. | 利用化石燃料燃烧放出的热量使分解产生氢气,是氢能开发的研究方向 | |
| C. | 化学电源放电、植物光合作用都能发生化学变化,并伴随能量的转化 | |
| D. | 若化学过程中断开化学键吸收的能量大于形成化学键所放出的能量,则反应放热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:H2O>NH3 | B. | 碱性:NaOH>Al(OH)3 | ||
| C. | 氧化性:F2>Cl2 | D. | 酸性:H2SO4>HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5mol | B. | 1.8mol | C. | 3.3mol | D. | 3.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| a | b | |||
| c | d |
| A. | a的氢化物水溶液显酸性 | |
| B. | 在这4种元素中,b的氢化物热稳定性最好 | |
| C. | c的氧化物是碱性氧化物 | |
| D. | d的氧化物对应水化物一定是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COO-)=c(Na+)时,参加反应的乙酸与氢氧化钠的物质的量之比为1:1 | |
| B. | c(CH3COO-)>c(Na+)>c(H+)>c(OH-)时,不一定是醋酸过量 | |
| C. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,一定是氢氧化钠过量 | |
| D. | c(CH3COO-)=c(Na+)时,该溶液一定呈中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com