
| »Æѧ¼ü | H-H | C-O | C=O | H-O | C-H |
| ¼üÄÜ£ØKJ•mol-1£© | 436 | 326 | 803 | 464 | 414 |
| ĻąĶ¬Ź±¼äÄŚCO2×Ŗ»ÆĀŹ | T1 | T2 | T3 | T4 | T5 |
| ·“Ó¦¢ń | 65% | 77% | 80% | 80% | 66.67% |
| ·“Ó¦¢ņ | 56% | 67% | 76% | 80% | 66.67% |
| ·“Ó¦¢ó | 48% | 62% | 72% | 80% | 66.67% |

·ÖĪö £Ø1£©·“Ó¦ČČ=·“Ó¦Īļ×ܼüÄÜ-Éś³ÉĪļ×ܼüÄÜ£»
£Ø2£©æÉÄę·“Ó¦µ½“ļĘ½ŗāŹ±£¬Ķ¬ÖÖĪļÖŹµÄÕżÄęĖŁĀŹĻąµČ£¬ø÷×é·ÖµÄÅØ¶Č”¢ŗ¬Įæ±£³Ö²»±ä£¬ÓÉ“ĖŃÜÉśµÄĘäĖüŅ»Š©Įæ²»±ä£¬ÅŠ¶ĻĘ½ŗāµÄĪļĄķĮæÓ¦Ėę·“Ó¦½ųŠŠ·¢Éś±ä»Æ£¬øĆĪļĄķĮæÓɱä»Æµ½²»±ä»ÆĖµĆ÷µ½“ļĘ½ŗā£»
£Ø3£©¢ŁĻąĶ¬ĪĀ¶ČĻĀ£¬ĻąĶ¬Ź±¼äÄŚCO2×Ŗ»ÆĀŹŌ½“ó£¬ĖµĆ÷“߻ƼĮŠ§¹ūŌ½ŗĆ£»
¢ŚT4Ź±“¦ÓŚĘ½ŗāדĢ¬£¬Õż·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ĪĀ¶ČŌ½øß×Ŗ»ÆĀŹŌ½Š”£¬T3Ę½ŗāŹ±×Ŗ»ÆĀŹÓ¦“óÓŚT4£¬a”¢bµć×Ŗ»ÆĀŹĻąµČ£¬¹ŹbµćĻņÕż·“Ó¦½ųŠŠ£»
¢ŪøĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ĪĀ¶ČÉżøߣ¬Ę½ŗāÄęĻņŅĘ¶Æ£»
¢ÜŅ»¶ØĢõ¼žĻĀ£¬Ķł2LŗćČŻĆܱÕČŻĘ÷ÖŠ³äČė1.2molCO2ŗĶ3.6molH2£¬ŌŚĪĀ¶ČĪŖT5Ź±£¬Ę½ŗāŹ±Cµć¶žŃõ»ÆĢ¼×Ŗ»ÆĀŹĪŖ66.67%£¬Ōņ×Ŗ»ÆµÄ¶žŃõ»ÆĢ¼ĪŖ1.2mol”Į66.67%=0.8mol£¬Ōņ£ŗ
CO2£Øg£©+3H2£Øg£©?CH3OH£Øg£©+H2O£Øg£©
ĘšŹ¼ÅØ¶Č£Ømol/L£©£ŗ0.6 1.8 0 0
±ä»ÆÅØ¶Č£Ømol/L£©£ŗ0.4 1.2 0.4 0.4
Ę½ŗāÅØ¶Č£Ømol/L£©£ŗ0.2 0.6 0.4 0.4
“śČėĘ½ŗā³£ŹżK=$\frac{c£ØC{H}_{3}OH£©”Įc£Ø{H}_{2}O£©}{c£ØC{O}_{2}£©”Į{c}^{3}£Ø{H}_{2}£©}$¼ĘĖć£»
¢Żµ±Ź±¼äµ½“ļt1Ź±£¬½«Éś³ÉµÄ¼×“¼ŗĶĖ®Ķ¬Ź±³żČ„£¬²¢Ī¬³ÖøĆĪĀ¶Č£¬Ė²¼ä¼×“¼µÄÅضČĪŖ£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬¶ųŗó¼×“¼µÄÅضČŌö“óĘ½ŗāדĢ¬²»±ä£¬µČŠ§ĪŖæŖŹ¼¼ÓČė0.2mol/LCO2ŗĶ0.6mol/LH2µ½“ļµÄĘ½ŗā£¬½įŗĻ¢ÜÖŠĘ½ŗā³£Źż¼ĘĖćĘ½ŗāÅØ¶Č£¬¾Ż“Ė×÷Ķ¼£®
½ā“š ½ā£ŗ£Ø1£©·“Ó¦ČČ=·“Ó¦Īļ×ܼüÄÜ-Éś³ÉĪļ×ܼüÄÜ£¬¹Ź”÷H=2”Į803kJ/mol+3”Į436kJ/mol-3”Į414kJ/mol-326kJ/mol-3”Į464kJ/mol=-46kJ/mol£¬¹Ź“š°øĪŖ£ŗ-46£»
£Ø2£©A£®»ģŗĻĘųĢå×ÜÖŹĮæ²»±ä£¬ŗćĪĀŗćČŻĻĀ£¬ČŻĘ÷ÄŚĘųĢåĆܶȏ¼ÖÕ±£³Ö²»±ä£¬¹ŹA“ķĪó£»
B£®Ę½ŗāŹ±ø÷×é·Öŗ¬Įæ²»±ä£¬CO2µÄĢå»ż·ÖŹż±£³Ö²»±äĖµĆ÷µ½“ļĘ½ŗā£¬¹ŹBÕżČ·£»
C£®H2O£Øg£©ÓėCO2£Øg£©µÄÉś³ÉĖŁĀŹÖ®±ČĪŖ1£ŗ1£¬ĖµĆ÷¶žŃõ»ÆĢ¼µÄÉś³ÉĖŁĀŹÓėĻūŗÄĖŁĀŹĻąµČ£¬·“Ó¦µ½“ļĘ½ŗā£¬¹ŹCÕżČ·£»
D£®ĪĀ¶Č²»±ä£¬Ę½ŗā³£Źż²»±ä£¬øĆ·“Ó¦µÄĘ½ŗā³£Źż±£³Ö²»±ä²»ÄÜĖµĆ÷µ½“ļĘ½ŗā£¬¹ŹD“ķĪó£»
E£®»ģŗĻĘųĢå×ÜÖŹĮæ²»±ä£¬Ėę·“Ó¦½ųŠŠ»ģŗĻĘųĢåĪļÖŹµÄĮæ¼õŠ”£¬Ę½¾łĻą¶Ō·Ö×ÓÖŹĮæŌö“ó£¬Ę½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»±äĖµĆ÷µ½“ļĘ½ŗā£¬¹ŹEÕżČ·£»
F£®Ėę·“Ó¦½ųŠŠ»ģŗĻĘųĢåĪļÖŹµÄĮæ¼õŠ”£¬ŗćĪĀŗćČŻĻĀŃ¹Ēæ¼õŠ”£¬ČŻĘ÷ÖŠŃ¹Ēæ±£³Ö²»±äĖµĆ÷µ½“ļĘ½ŗā£¬¹ŹFÕżČ·£¬
¹ŹŃ”£ŗBCEF£»
£Ø3£©¢ŁĻąĶ¬ĪĀ¶ČĻĀ£¬ĻąĶ¬Ź±¼äÄŚ·“Ó¦¢ńÖŠCO2×Ŗ»ÆĀŹŌ½“ó£¬ĖµĆ÷·“Ó¦¢ń“߻ƼĮŠ§¹ūŌ½ŗĆ£¬¹Ź“š°øĪŖ£ŗ·“Ó¦¢ń£»
¢ŚT4Ź±“¦ÓŚĘ½ŗāדĢ¬£¬Õż·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ĪĀ¶ČŌ½øß×Ŗ»ÆĀŹŌ½Š”£¬T3Ę½ŗāŹ±×Ŗ»ÆĀŹÓ¦“óÓŚT4£¬a”¢bµć×Ŗ»ÆĀŹĻąµČ£¬¹ŹbµćĻņÕż·“Ó¦½ųŠŠ£®Ōņbµćv£ØÕż£©£¾v£ØÄę£©£¬¹Ź“š°øĪŖ£ŗ£¾£»
¢ŪøĆ7·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ĪĀ¶ČÉżøߣ¬Ę½ŗāÄęĻņŅĘ¶Æ£¬¶žŃõ»ÆĢ¼×Ŗ»ÆĀŹ½µµĶ£¬
¹Ź“š°øĪŖ£ŗøĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ĪĀ¶ČÉżøߣ¬Ę½ŗāÄęĻņŅĘ¶Æ£»
¢ÜŅ»¶ØĢõ¼žĻĀ£¬Ķł2LŗćČŻĆܱÕČŻĘ÷ÖŠ³äČė1.2molCO2ŗĶ3.6molH2£¬ŌŚĪĀ¶ČĪŖT5Ź±£¬Ę½ŗāŹ±Cµć¶žŃõ»ÆĢ¼×Ŗ»ÆĀŹĪŖ66.67%£¬Ōņ×Ŗ»ÆµÄ¶žŃõ»ÆĢ¼ĪŖ1.2mol”Į66.67%=0.8mol£¬Ōņ£ŗ
CO2£Øg£©+3H2£Øg£©?CH3OH£Øg£©+H2O£Øg£©
ĘšŹ¼ÅØ¶Č£Ømol/L£©£ŗ0.6 1.8 0 0
±ä»ÆÅØ¶Č£Ømol/L£©£ŗ0.4 1.2 0.4 0.4
Ę½ŗāÅØ¶Č£Ømol/L£©£ŗ0.2 0.6 0.4 0.4
ŌņĘ½ŗā³£ŹżK=$\frac{c£ØC{H}_{3}OH£©”Įc£Ø{H}_{2}O£©}{c£ØC{O}_{2}£©”Į{c}^{3}£Ø{H}_{2}£©}$=$\frac{0.4”Į0.4}{0.2”Į0£®{6}^{3}}$=$\frac{100}{27}$£¬
¹Ź“š°øĪŖ£ŗ$\frac{100}{27}$£»
¢Żµ±Ź±¼äµ½“ļt1Ź±£¬½«Éś³ÉµÄ¼×“¼ŗĶĖ®Ķ¬Ź±³żČ„£¬²¢Ī¬³ÖøĆĪĀ¶Č£¬Ė²¼ä¼×“¼µÄÅضČĪŖ£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬¶ųŗó¼×“¼µÄÅضČŌö“óĘ½ŗāדĢ¬²»±ä£¬µČŠ§ĪŖæŖŹ¼¼ÓČė0.2mol/LCO2ŗĶ0.6mol/LH2µ½“ļµÄĘ½ŗā£¬
CO2£Øg£©+3H2£Øg£©?CH3OH£Øg£©+H2O£Øg£©
ĘšŹ¼ÅØ¶Č£Ømol/L£©£ŗ0.2 0.6 0 0
±ä»ÆÅØ¶Č£Ømol/L£©£ŗx 3x x x
Ę½ŗāÅØ¶Č£Ømol/L£©£ŗ0.2-x 0.6-3x x x
$\frac{x”Įx}{£Ø0.2-x£©”Į£Ø0.6-3x£©^{3}}$=$\frac{100}{27}$£¬½āµĆx=0.1£¬¹ŹĘ½ŗāŹ±¼×“¼ÅضČĪŖ0.1mol/L£¬t1Ź±æĢŗóCH3OHµÄÅØ¶Č±ä»Æ×ÜĒ÷ŹĘĒśĻßĪŖ£ŗ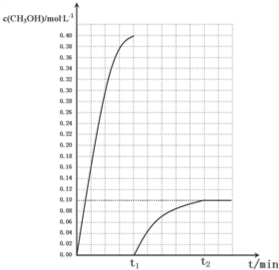 £¬
£¬
¹Ź“š°øĪŖ£ŗ £®
£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗā¼ĘĖćÓėÓ°ĻģŅņĖŲ”¢Ę½ŗāדĢ¬ÅŠ¶Ļ”¢»ÆŃ§Ę½ŗāĶ¼Ļ󔢷“Ó¦ČČ¼ĘĖćµČ£¬×÷Ķ¼ĪŖŅדķµć£¬Ń§ÉśČŻŅ×ŗöĀŌ¶ž“ĪĘ½ŗāŹ±¼×“¼µÄÅØ¶Č£¬ÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 ŌŚ100mL0.1mol•L-1ĀĮļ§·Æ[NH4Al£ØSO4£©2•12H2O]µÄĖ®ČÜŅŗÖŠ£¬ÖšµĪµĪČė0.1mol•L-1µÄBa£ØOH£©2ČÜŅŗ£¬ĖłµĆ³ĮµķµÄÖŹĮæÓėBa£ØOH£©2ČÜŅŗµÄĢå»żĒśĻßČēĶ¼ĖłŹ¾[ŅŃÖŖBa£ØAlO2£©2Ņ×ČÜŅ×µēĄė]£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
ŌŚ100mL0.1mol•L-1ĀĮļ§·Æ[NH4Al£ØSO4£©2•12H2O]µÄĖ®ČÜŅŗÖŠ£¬ÖšµĪµĪČė0.1mol•L-1µÄBa£ØOH£©2ČÜŅŗ£¬ĖłµĆ³ĮµķµÄÖŹĮæÓėBa£ØOH£©2ČÜŅŗµÄĢå»żĒśĻßČēĶ¼ĖłŹ¾[ŅŃÖŖBa£ØAlO2£©2Ņ×ČÜŅ×µēĄė]£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©| A£® | aµćČÜŅŗÖŠ“óĮæ“ęŌŚµÄĄė×ÓÓŠNH4+ŗĶSO42- | |
| B£® | bµćČÜŅŗÖŠc£ØNH3•H2O£©Ō¼ĪŖ0.1mol•L-1 | |
| C£® | a”śb¹ż³ĢÖŠ£¬·“Ó¦µÄÖ»ÓŠSO42- | |
| D£® | b”śc¹ż³ĢÖŠ£¬·“Ó¦µÄŹĒAl£ØOH£©3ŗĶNH4+ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
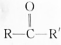 ½į¹¹£©£»BÄÜÓėĻõĖįŅųµÄ°±ČÜŅŗ×÷ÓĆÉś³É°×É«³Įµķ£¬µ«C²»ÓėÖ®·“Ó¦£®ŹŌĶĘ²āA”¢B”¢CµÄ¹¹ŌģŹ½£®
½į¹¹£©£»BÄÜÓėĻõĖįŅųµÄ°±ČÜŅŗ×÷ÓĆÉś³É°×É«³Įµķ£¬µ«C²»ÓėÖ®·“Ó¦£®ŹŌĶĘ²āA”¢B”¢CµÄ¹¹ŌģŹ½£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ō×ÓŃõ±ČŃõĘų»ÆѧŠŌÖŹ»īĘĆ£¬¶žÕß»„ĪŖĶ¬ĖŲŅģŠĪĢå | |
| B£® | ŅųÓėŅųŗĻ½šµÄ±”Ĥ²ÄĮĻ»ÆѧŠŌÖŹ»īĘĆ | |
| C£® | Ō×ÓŃõŗĶ×ĻĶā¹āµÄ·ųÕÕ¶Ō¶žĮņ»ÆīāČ󻬱”Ĥ²śĘ·Ć»ÓŠÓ°Ļģ | |
| D£® | ¶žĮņ»ÆīāČ󻬱”Ĥ²śĘ·²»ŹŹŗĻÓĆ×÷ŗ½ĢģĘ÷µÄČ󻬼Į |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

| T/K | 298 | 398 | 498 |
| Ę½ŗā³£ŹżK | 4.1”Į106 | K1 | K2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 2H2S+SO2ØT3S”ż+2H2O | B£® | Zn+CuSO4ØTCu+ZnSO4 | ||
| C£® | KClO3+6HClØTKCl+3Cl2”ü+H2O | D£® | 2FeCl2+Cl2ØT2FeCl3 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com