
室温下,取0.2mol/L H2 A溶液与xmol/L NaOH溶液等体积混合(忽略混合后溶液体积变化),测得混合溶液的pH=y,下列推断不正确的是
A.当x=0.2,则混合溶液中y可能大于7或小于7
B.当x=0.2,y=1,则混合溶液中:c(H+)=c(A-)+c(OH-)
C.当x=0.3,y>7,则混合溶液中:c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D.当x=0.4,则混合溶液中:[c(Na+)+c(H+)]>2c(A2-)
C
【解析】
试题分析:A.当x=0.2,则混合后二者恰好完全反应产生NaHA。若NaHA是强酸的酸式盐或是弱酸的酸式盐,HA-的电离大于其水解作用,则溶液显酸性,y小于7,若NaHA是弱酸的酸式盐,HA-的水解大于其电离作用,则溶液显碱性,y大于7,正确;B.当x=0.2,y=1,反应产生NaHA ,c(NaHA)=0.1mol/L。由于y=1,即c(H+)=0.1mol/L,NaHA是强酸的酸式盐,则根据物料守恒可得混合溶液中:c(H+)= c(A-) +c(OH-),正确;C.当x=0.3,则反应产生的是NaHA、Na2A等浓度的混合溶液。y>7,则混合溶液中离子浓度关系是c(Na+) >c(HA-)>c(A2-)> c(OH-)>c(H+),错误;D。当x=0.4,反应反应产生Na2A。则根据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+ c(HA-)+ 2c(A2-)。全部大于部分的和,因此混合溶液中:[c(Na+)+ c(H+)]>2c(A2-),正确。
考点:考查酸碱混合溶液中离子的浓度大小比较的知识。


 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案科目:高中化学 来源:2014-2015学年福建省高三上学期第四次月考化学试卷(解析版) 题型:填空题
(12分)X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y的氢化物和W的氢化物具有相同的电子数。在中学范围内X的单质只有氧化性,且是空气的主要成份之一。
(1)写出实验室制取W2反应的离子方程式 。
(2)某小组设计如图所示的装置,分别研究YX2和W2的性质。
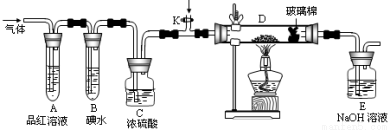
①分别通入YX2和W2,在装置 A中观察到的现象是否相同 (填“相同”或“不相同”);若装置D中装的是铁粉,当通入足量W2时观察到的现象为 ;若装置D中装的是五氧化二钒(作催化剂),当通入足量YX2时,打开K通入适量X2,化学反应方程式为 ;
A中观察到的现象是否相同 (填“相同”或“不相同”);若装置D中装的是铁粉,当通入足量W2时观察到的现象为 ;若装置D中装的是五氧化二钒(作催化剂),当通入足量YX2时,打开K通入适量X2,化学反应方程式为 ;
②若装置B中装有5.0mL 1.0 ×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为
×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为  。
。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,再向该试管中加入过量的下列溶液也无沉淀生成的是 (填字母)。
A.氨水
B.稀盐酸
C.稀硝酸
D.氯化钙
E.双氧水
F.硝酸银
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期10月月考化学试卷(解析版) 题型:填空题
(12分)A、B、C、D为原子序数依次增大的四种短周期元素,其性质或结构信息如下表:
元素 | A | B | C | D | E |
性质 或结 构信 息 | 室温下单质呈气态,原子最外层电子数与D相同 | D3B中阳离子与阴离子的电子层结构相同 | A和C可形成两种常见的化合物甲和乙,乙具有弱酸性 | 单质质软、银白色固体、导电性强,在空气中燃烧生成淡黄色固体 | E的气态氢化物和最高价氧化物对应的水化物均为强酸,C、D和E三种元素形成的一种盐丙为某消毒液的主要成分 |
试回答以下问题
(1)B在周期表中的位置是 ,B的氢化物与E的氢化物比较,沸点较高的是 (填化学式)。
(2)D3B可与水反应生成2种碱性物质,请写出这一化学方程式 。
(3)写出丙的电子式为 。并说明丙在空气中漂白的原理(用化学方程式表示) 。(请参考下表数据)
酸 | 电离常数 |
HClO | Ka=3.0×10-8 |
H2CO3 | Ka1=4.3×10-7,Ka2=5.6×10-11 |
(4)由A、B、C、D四种元素中的三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈碱性。将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成深绿色溶液,写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从小到大的是
A.p (Ne) < p (H2) < p (O2) B.p (H2) < p (O2) < p (Ne)
C.p (O2) < p (Ne) < p (H2) D.p (H2) < p (Ne) < p (O2)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:填空题
(10分)甲、乙、丙均为中学化学常见的气体单质,A、B、C为常见的化合物,A和B都极易溶于水,用玻璃棒分别蘸取A和B的浓溶液后,相互靠近会看到白烟。各物质之间存在如下图所示的转化关系:

请回答下列问题:
(1)丙与A反应生成乙和C的化学反应方程式为——————
(2)向0.1 mol/L的C溶液中通入A至显中性,溶液中各离子浓度由大到小的顺序为:__________.
(3)常温下取M的饱和溶液与AgI的饱和溶液等体积混合,再加入足量的AgNO3浓溶液发生反应,则生成沉淀的物质的量较多的是________。(填化学式)
(4)电解尿素[CO(NH2)2]的碱性溶液制取甲的装置示意图如右图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极)。

电解时,b极的电极反应是_______。若在a极产生112mL气体(标准状况),则消耗尿素的质量为______g。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.1.7 g羟基所含电子的数目为NA
B.0.1 mol丙烯醛中含有双键的数目为0.1NA。
C.室温时,pH=13的1.0L Ba(OH)2溶液中含有OH-的数目为0.2NA
D.标准状况下,7.8 g苯中含氢原子的数目为0.6NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三12月校际联合检测化学试卷(解析版) 题型:实验题
(14分)某化学兴趣小组为研究生铁(含碳)与浓硫酸的反应情况及产物性质,设计如下实验。请回答下列问题:
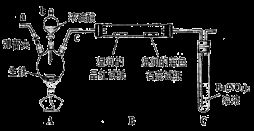
(1)按上图所示装置进行实验(夹持装置及尾气处理装置未画出)。仪器b的名称为_____________:实验过程中,装置B中观察的现象是_______________;装置C中有白色沉淀生成,该沉淀是______________(填化学式)。
(2)装置A中还会产生CO2气体,请写出产生CO2的化学方程式:________________________。
(3)为了验证装置A中产生的气体中含有CO2,应先从下列①~④中选出必要的装置连接A装置中c处管口,从左到右的顺序为_______________(填序号);然后再进行的操作是从a处多次鼓入N2,其目的是________________________________。

(4)某同学通过验证实验后期装置A中产生的气体中还含有H2,理由是_____________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三12月校际联合检测化学试卷(解析版) 题型:选择题
下列关于物质的性质与应用相对应的是
A.氯气有毒,不可用作自来水的杀菌消毒
B.FeCl3溶液能与Cu反应,可用于蚀刻印刷电路
C.硫粉具有还原性,可用于制造黑火药
D.Na2O2具有强氧化性,可用作呼吸面具的供氧剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省六校联盟高三第三次联考理科综合试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W的原子序数依次增大,原子半径r(W)>r(Y)>r(Z)>r(X)。X与W同主族,Z原子最外层电子数是其内层电子总数的3倍,Z原子的核电荷数等于X、Y原子核电荷数之和。下列说法正确的是
A.工业上常用电解的方法制备W的单质
B.元素Z的简单气态氢化物的热稳定性比Y的强
C.仅由X、Y、Z三种元素形成的化合物的水溶液一定呈碱性
D.化合物X2Z2与W2Z2所含化学键类型完全相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com