
| A. | 因浓硫酸具有强氧化性,故不可用它来干燥氢气 | |
| B. | 浓硫酸不活泼,可用铁铝容器存放 | |
| C. | 浓硫酸有强氧化性,稀硫酸没有氧化性 | |
| D. | 浓硫酸难挥发,可用来制HF、HCl等挥发性酸 |
分析 A.浓硫酸具有吸水性,可干燥气体;
B.浓硫酸与Fe、Al发生钝化;
C.浓硫酸、稀硫酸均具有氧化性;
D.根据难挥发的酸制挥发性的酸.
解答 解:A.浓硫酸具有吸水性,可干燥氢气,与强氧化性无关,故A错误;
B.浓硫酸与Fe、Al发生钝化,可用铁铝容器存放,故B错误;
C.浓硫酸、稀硫酸均具有氧化性,但浓硫酸具有强氧化性,而稀硫酸具有弱氧化性,故C错误;
D.浓硫酸是难挥发的酸,而HF、HCl是挥发性酸,所以可用浓硫酸来制HF、HCl等挥发性酸,故D正确;
故选D.
点评 本题考查浓硫酸的性质,为高频考点,把握浓硫酸的特性为解答的关键,注意性质与用途的关系,题目难度不大,选项B为解答的易错点.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 含杂质的物质 | 试剂 | 除杂方法 |
| A | C2H4(SO2) | 溴水 | 洗气 |
| B | C6H6(Br2) | NaOH溶液 | 分液 |
| C | C6H5NO2(HNO3) | NaOH溶液 | 分液 |
| D | C2H2(H2S) | CuSO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外的电子像云雾一样笼罩在原子核周围,故称电子云 | |
| B. | s能级原子轨道呈球形,处于该轨道上的电子只能在球壳内运动 | |
| C. | p能级原子轨道呈哑铃状,随着能层的增加,p能级原子轨道也在增多 | |
| D. | p能级原子轨道与s能级原子轨道的平均半径都随能层序数的增大而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL1mol/L的Na2CO3溶液中含有6.02×1022个CO32- | |
| B. | 足量铁粉在0.05molC12中充分燃烧,反应时转移6.02x1022个电子 | |
| C. | 将4gNaOH溶于100g蒸馏水,所得溶液物质的量浓度是1mol/L | |
| D. | 常温下,将9g铝片投入500mL18.4mol•L-1的硫酸中,产生H2比11.2L多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
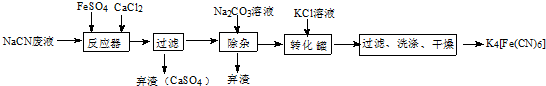
 ;实验室用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液,再用蒸馏水稀释.
;实验室用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液,再用蒸馏水稀释.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
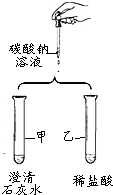 如图是某小组验证碳酸钠性质的实验方案.
如图是某小组验证碳酸钠性质的实验方案.| 实验步骤 | 实验现象 | 结论 |
| 取少量的废液于试管中,滴加2~3滴石蕊试液,振荡. | 无现象 | 废液的pH=7; 猜想Ⅰ成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Cu2+、H+、Cl-、HSO3- | |
| B. | 能使pH试纸呈红色的溶液:Fe2+、Na+、Cl-、NO3- | |
| C. | Na2CO3溶液:K+、NO3-、Cl-、Al3+ | |
| D. | $\frac{{K}_{W}}{c(H)}$=0.1mol/L的溶液:Na+、K+、SiO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 考古时可用12C测定一些文物的年代 | |
| B. | 可在元素周期表的过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料 | |
| C. | 乙烯是一种重要的基本化工原料,它的产量可以用来衡量一个国家的石油化工发展水平 | |
| D. | 红葡萄酒的密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com