

【题目】下列热化学方程式或离子方程式中,正确的是( )
A. 氯化镁溶液与氨水反应:Mg2+ + 2OH-= Mg(OH)2 ↓
B. 500℃、30MPa下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g)△H= -38.6kJ·mol-1
2NH3(g)△H= -38.6kJ·mol-1
C. 甲烷的标准燃烧热△H= -890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g) + 2O2(g) = CO2(g)+2H2O(g) △H= -890.3kJ·mol-1
D. 氧化铝溶于NaOH溶液:Al2O3 + 2OH-=2AlO2-+ H2O
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】某温度下,浓度都是1mol·L-1的两种气体X2和Y2在密闭容器中反应,经过tmin后,测得物质的浓度分别为:c(X2)=0.4mol·L-1,c(Y2)=0.8mol·L-1,则该反应的方程式可表示为()
A. X2+2Y2![]() 2XY2B. 2X2+Y2
2XY2B. 2X2+Y2![]() 2X2Y
2X2Y
C. X2+3Y2![]() 2XY3D. 3X2+Y2
2XY3D. 3X2+Y2![]() 2X3Y
2X3Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11、浓度均为 ![]() 的
的![]() 和
和 ![]() ,在一定条件下发生反应
,在一定条件下发生反应![]()
![]()
![]() ,测得
,测得![]() 的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是
的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是
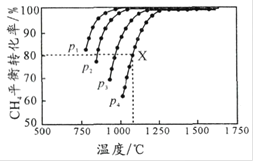
A.平衡时CO与![]() 的物质的量比为
的物质的量比为![]()
B.![]() 由大到小的顺序为
由大到小的顺序为 ![]()
C.![]() , p
, p![]() 条件下,该反应
条件下,该反应![]() 时达到平衡点X,则
时达到平衡点X,则 ![]()
D.随着温度升高,该反应的平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=10 的 X、Y 两种碱溶液各 1 mL,分别稀释至 100 mL,其 pH 与溶液体 积(V)的关系如图所示,下列说法正确的是( )

A.若 8<a<10,则 X、Y 都是弱碱
B.X、Y 两种碱溶液中溶质的物质的量浓度一定相等
C.稀释后,X 溶液的碱性比 Y 溶液的碱性强
D.分别完全中和 X、Y 这两种碱溶液时,消耗同浓度盐酸的体积 Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能量转化过程与氧化还原反应无关的是
A. 硅太阳能电池 | B. 锂离子电池放电 | C. 火箭的燃料燃烧 | D. 葡萄糖提供能量 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组针对反应![]() 进行研究。下列研究结论正确的是
进行研究。下列研究结论正确的是
A.若向绝热恒容密闭容器中通入一定量的![]() 和
和![]() 进行反应,正反应速率随时间变化的曲线如图Ⅰ所示,则A点反应达到平衡
进行反应,正反应速率随时间变化的曲线如图Ⅰ所示,则A点反应达到平衡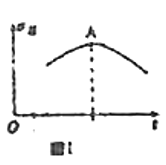
B.若恒温条件下进行反应,Y的平衡转化率![]() 与压强
与压强![]() 的关系如图Ⅱ所示,则B点
的关系如图Ⅱ所示,则B点![]()
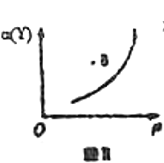
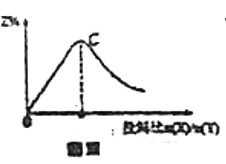
C.若恒温恒容,改变X与Y的投料比![]() 进行反应,平衡时Z的百分含量
进行反应,平衡时Z的百分含量![]() 随
随![]() 变化的曲线如图Ⅲ,则C点
变化的曲线如图Ⅲ,则C点![]()
D.若恒容条件下投入一定量的X和Y边加热边进行反应,X的体积分数![]() 随温度的变化如图Ⅳ所示,则该反应反应物的总能量高于生成物的总能量
随温度的变化如图Ⅳ所示,则该反应反应物的总能量高于生成物的总能量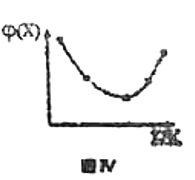
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热。下列说法中,正确的是

A. 实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯间填满碎纸条的作用是固定小烧杯
D. 若将盐酸体积改为60 mL,理论上所求中和热不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在催化剂作用下,用乙醇制乙烯,乙醇转化率和乙烯选择性(生成乙烯的物质的量与乙醇转化的物质的量的比值)随温度、乙醇进料量(单位:mL·min-1)的关系如图所示(保持其他条件相同)。

在410~440℃温度范围内,下列说法不正确的是
A. 温度一定时,随乙醇进料量增大,乙醇转化率减小
B. 温度一定时,随乙醇进料量增大,乙烯选择性增大
C. 乙醇进料量一定时,随温度的升高,乙烯选择性一定增大
D. 选择适当的催化剂在一定条件下,可大幅提高乙烯在最终产物中的比率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:

下列说法错误的是( )
A.反应①阶段,参加反应的NaClO3和SO2的物质的量之比为2:1
B.若反应①通过原电池来实现,则ClO2是正极产物
C.反应②中的H2O2可用NaClO4代替
D.反应②条件下,ClO2的氧化性大于H2O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com