
向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150 mL 4 mol·L-1的稀硝酸恰好使混合物完全溶解,放出2.24 L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
( )
A.0.21 mol B.0.25 mol
C.0.3 mol D.0.35 mol
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
(1)工业制氢气的一个重要反应是:CO(g)+H2O(g) CO2(g)+ H2(g)
CO2(g)+ H2(g)
已知在25℃时:(1)C(石墨)+1/2O2(g)=CO(g) ΔH1=—111kJ/mol
(2)H2(g)+1/2O2(g)=H2O(g) ΔH2=—242kJ/mol
(3)C(石墨)+O2(g)=CO2(g) ΔH3=—394kJ/mol
试计算25℃时一氧化碳与水作用转化为氢气和二氧化碳反应的反应热 。
(2)已知上述反应在427℃ 时的平衡常数是9.4。如果反应开始时,一氧化碳和水蒸气的浓度都是0.01 mol/L,计算一氧化碳在此反应条件下的转化率 。(保留3位有效数字)。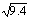 ≈3.07。
≈3.07。
(3)对于化学反应,速率也是研究的重要内容。在一密闭容器中充入1mol H2和1mol I2,压强为p(Pa) ,并在一定温度下使其发生反应:H2(g)+I2(g)  2HI(g) ΔH<0。达到平衡后,以下能加快反应速率的是( )
2HI(g) ΔH<0。达到平衡后,以下能加快反应速率的是( )
①保持容器容积不变,向其中加入1mol H2。
②保持容器容积不变,向其中加入1mol N2(N2不参加反应)。
③保持容器内气体压强不变,向其中加入1mol N2(N2不参加反应)。
④保持容器内气体压强不变,向其中加入1mol H2和1mol I2。
⑤提高起始的反应温度。
(4)2.0 mol PCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:
PCl3(g)+ Cl2(g) PCl5(g)。达平衡时,PCl5为0.40mol,如果此时移走1.0 mol PCl3和0.5molCl2,在相同温度下再达平衡时PCl5的物质的量是( )
PCl5(g)。达平衡时,PCl5为0.40mol,如果此时移走1.0 mol PCl3和0.5molCl2,在相同温度下再达平衡时PCl5的物质的量是( )
A.0.4 mol B.0.2 mol C.小于0.2 mol D.大于0.2 mol,小于0.4 mol
(5)已知25℃下,醋酸溶液中存在下述关系: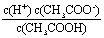 =1.75×10-5其中的数值是该温度下醋酸的电离平衡常数。若醋酸的起始浓度为0.010 mol/L,平衡时c(H+)= . (
=1.75×10-5其中的数值是该温度下醋酸的电离平衡常数。若醋酸的起始浓度为0.010 mol/L,平衡时c(H+)= . (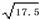 ≈4.18)
≈4.18)
(提示:醋酸的电离常数很小,平衡时的c(CH3COOH)可近似视为仍等于0.010 mol/L)
(6)向明矾溶液中逐滴加入Ba(OH)2溶液至硫酸根离子刚好沉淀完全时,溶液的pH 7(填<、>、=), 离子反应总方程式为 。
向明矾溶液中逐滴加入Ba(OH)2溶液至铝离子刚好沉淀完全时,溶液的pH 7(填<、>、=), 离子反应总方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
铁元素是典型的变价金属元素,它在化合物中主要表现为+2价和+3价,请归纳总结:
(1)Fe单质通常与哪些氧化剂反应生成 +2价?写出有关反应的化学方程式或离子方程式。
+2价?写出有关反应的化学方程式或离子方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
在FeCl3、CuCl2混合溶液中,加入一定量的铁屑,反应完全后将固体滤出,下列说法中正确的是 ( )
A.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+
B.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,可能含Cu2+和Fe3+
C.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe3+和Fe2+,一定不含Cu2+
D.若滤出的固体中含有铁和铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+和Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x的值:__________________(列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为__________。在实验室中,FeCl2可用铁粉和__________反应制备,FeCl3可用铁粉和__________反应制备。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对化学反应的认识正确的是:
A.化学反应过程中,一定有化学键的断裂和形成
B.化学反应过程中,某离子被沉淀完全时,该离子在溶液中的浓度即为0
C.化学反应过程中,分子的种类和数目一定发生改变
D.放热反应的反应速率,一定比吸热反应的反应速率快
查看答案和解析>>
科目:高中化学 来源: 题型:
部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25℃) | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
下列选项正确的是[微软用户14]
A. 2CN-+H2O+CO2=2HCN+CO32-
B. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
C. 物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-) < c(K+)-c(CN-)
D. c(NH4+) 相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中,
c(NH4HCO3)>c(NH4CN) >c(HCOONH4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com