
 .
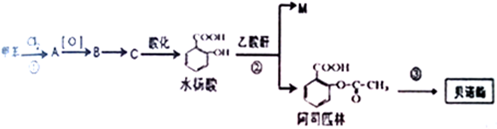
. 分析 根据题中各物转化关系,根据水杨酸的结构可知,甲苯与氯气在铁粉做催化剂的条件下发生苯环上的取代,生成A为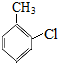 ,A发生氧化反应生成B为
,A发生氧化反应生成B为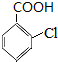 ,B发生碱性水解得C为
,B发生碱性水解得C为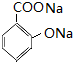 ,C酸化得水杨酸,水杨酸与乙酸酐发生取代反应生成阿司匹林和M,则M为CH3COOH,阿司匹林发生取代反应生成贝诺酯,据此答题.
,C酸化得水杨酸,水杨酸与乙酸酐发生取代反应生成阿司匹林和M,则M为CH3COOH,阿司匹林发生取代反应生成贝诺酯,据此答题.
解答 解:根据题中各物转化关系,根据水杨酸的结构可知,甲苯与氯气在铁粉做催化剂的条件下发生苯环上的取代,生成A为 ,A发生氧化反应生成B为
,A发生氧化反应生成B为 ,B发生碱性水解得C为
,B发生碱性水解得C为 ,C酸化得水杨酸,水杨酸与乙酸酐发生取代反应生成阿司匹林和M,则M为CH3COOH,阿司匹林发生取代反应生成贝诺酯,
,C酸化得水杨酸,水杨酸与乙酸酐发生取代反应生成阿司匹林和M,则M为CH3COOH,阿司匹林发生取代反应生成贝诺酯,
(1)根据贝诺酯的结构简式可知其分子式为C17H15O5N,故答案为:C17H15O5N;
(2)反应①是甲苯与氯气在铁粉做催化剂的条件下发生苯环上的取代,所以反应条件为铁粉(或氯化铁),B为 ,B含有的含氧官能团名称是羧基,反应②的类型取代反应,
,B含有的含氧官能团名称是羧基,反应②的类型取代反应,
故答案为:铁粉(或氯化铁);羧基;取代反应;
(3)根据上面的分析可知,M的结构简式为CH3COOH,故答案为:CH3COOH;
(4)水杨酸中的酚羟基能民碳酸钠反应但不能与碳酸氢钠反应,所以等量的水杨酸分别与足量Na2CO3溶液、NaHCO3溶液反应,消耗Na2CO3和NaHCO3的物质的量之比是2:1,
故答案为:2:1;
(5)水杨酸中有酚羟基,能与氯化铁溶液显色,而阿司匹林中没有,所以阿司匹林晶体中残留少量的水杨酸,可用FeCl3溶液检验,实验室利用阿司匹林和水杨酸在乙酸乙酯中溶解度的差异,用结晶法提纯阿司匹林,①用少量热的乙酸乙酯溶解晶体,②冷却结晶,③经过滤洗涤得到纯净的阿司匹林晶体,
故答案为:FeCl3溶液;冷却结晶;
(6)反应③的化学方程式为 ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,根据阿司匹林与水杨酸的结构推断是解题的关键,需要学生根据转化关系判断,题目难度中等,注重对学生的自学能力、理解能力、分析归纳能力、知识迁移能力的考查.


科目:高中化学 来源: 题型:选择题
| A. | 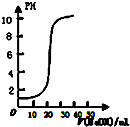 表示用0.1000mol/L的NaOH溶液滴定20.00ml,0.1000mol/L的醋酸溶液得到的滴定曲线 | |
| B. | 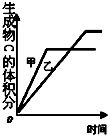 表示压强对可逆反应2A (g)+B (g)?3C (g)+D (s)的影响且甲的比乙的压强大 | |
| C. | 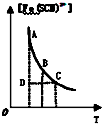 表示可逆反应Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq)平衡时,物质的量浓度[Fe(SCN)2+]与温度T的关系,反应处于D点时,一定有V(正)>V(逆) | |
| D. | 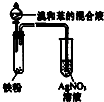 所示装置可证明溴与苯发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入MnCO3的目的是除去Fe3+ | |
| B. | 常温下,pH=4时,Fe3+已除尽 | |
| C. | 反应Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq)的K=1.35×1022 | |
| D. | Mn2(OH)2CO3、Mn(OH)2都可以替代MnCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
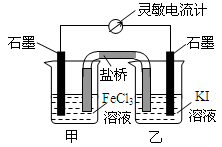
| A. | 反应开始时,甲池中电极反应为Fe3++e-=Fe2+ | |
| B. | 反应开始时,盐桥中的阴离子向乙池迁移 | |
| C. | 反应处于化学平衡状态时,甲、乙两池中离子浓度不再变化 | |
| D. | 反应处于化学平衡状态时,电子沿着石墨(乙池)→电流计→石墨(甲池)路径流动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
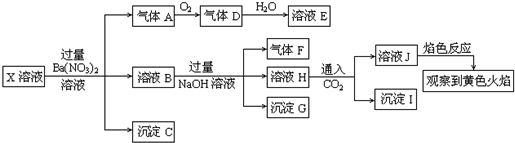
| A. | 溶液J焰色反应显黄色,则说明原溶液中存在Na+ | |
| B. | 沉淀G中加入盐酸溶解,滴加一滴KSCN溶液显红色,可以确定原溶液中有Fe3+ | |
| C. | X中不能确定的离子是 A13+、Fe3+、Na+、K+和C1- | |
| D. | 沉淀I一定是Al(OH )3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05mol•L-1 | B. | 0.1 mol•L-1 | C. | 0.5 mol•L-1 | D. | 1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 断开1 mol O-O键比断开1 mol N-N键所需能量少448kJ | |
| B. | 断开1 mol H-O键比断开1 mol H-N键所需能量相差约72.6kJ | |
| C. | 由以上键能的信息可知H2O的沸点比NH3高 | |
| D. | 由元素非金属性的强弱可知 H一O键比H一N键弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 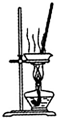 装置可用于蒸干氯化铝溶液制A1C13 | |
| B. | 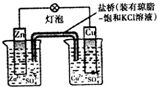 装置盐桥中的K+自右向左移动 | |
| C. | 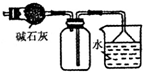 装置可用于收集NH3或HCl气体,并防止倒吸 | |
| D. |  装置可用于分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com