
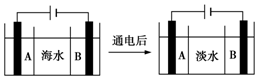
 水是一种重要的自然资源,是人类赖以生存不可或缺的物质,水质优劣直接影响人体健康.海水是人类资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.
水是一种重要的自然资源,是人类赖以生存不可或缺的物质,水质优劣直接影响人体健康.海水是人类资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.分析 (1)明矾、硫酸铝、硫酸铁等可水解生成具有吸附性的胶体;
(2)根据离子的定向移动判断;
通电时,阳极发生氧化反应生成氯气.
解答 解:(1)混凝剂是吸附水中的微小悬浮颗粒,凝聚成较大的颗粒,而快速沉降的主要作用,要具备水解生成胶体的性质,所以常有铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,水解离子反应为A13++3H2O?Al(OH)3(胶体)+3H+;
故答案为:明矾净水解反应为A13++3H2O?Al(OH)3(胶体)+3H+,Al(OH)3(胶体)可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉,达到净化目的;
(2)①阳离子交换膜只允许阳离子自由通过,隔膜B和阴极相连,阴是阳离子放电,所以隔膜B是阳离子交换膜,阳离子向阴极移动,以得到得到淡水的目的;
故答案为:B;
②通电后,阳极是氯离子放电,生成氯气,其电极反应为:2Cl--2e-═Cl2↑;
故答案为:2Cl--2e-═Cl2↑.
点评 本题考查盐的水解原理的应用及水的净化、电解原理,明确水解原理和电解原理、物质的性质及发生的化学反应、化学用语的应用即可解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、NO3-、Br- | B. | Na+、NH4+、NO3-、Cl- | ||
| C. | K+、Na+、HCO3-、NO3- | D. | K+、Cu2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
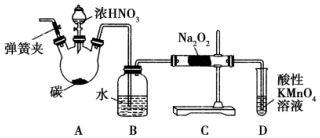 亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水为原料制备亚硝酸钠的装置如图所示.
亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水为原料制备亚硝酸钠的装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol/L的稀盐酸1L | B. | 73gHCl | ||
| C. | 44.8LHCl | D. | 1.204×1024个HCl分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
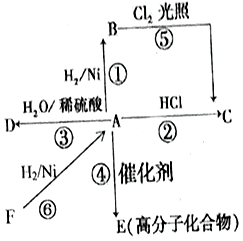 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 单位时间内生成1 mol的H2,同时生成2 mol 的HI | |
| B. | 容器内的总压强不随时间的变化而变化 | |
| C. | 1mol I-I 键断裂的同时有2mol HI键形成 | |
| D. | 容器内气体颜色不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH+NaHCO3→Na2CO3+H2O | |
| B. | Ca(OH)2+Ca(HCO3)2→2CaCO3↓+2H2O | |
| C. | 2NaOH+NH4HCO3→NH3?H2O+Na2CO3+H2O | |
| D. | NaOH+Ca(HCO3)2→2CaCO3↓+H2O+NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2O2 与H2O反应制备O2 :2Na2O2 +2H2O═4Na++4OH-+O2↑ | |
| B. | Cl2通入石灰乳中:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 氢氧化钠溶液腐蚀玻璃:2OH-+SiO2═SiO32-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com