
| 实验编号 | 实验操作 | 实验现象 |
| a | 分别在试管A、B中加入5mL 5% H2O2溶液,各滴入2滴1mol•L-1 FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡 | 试管A中无明显气泡产生 试管B中出现大量气泡 |
| b | 另取两支试管分别加入5mL 5% H2O2溶液和5mL 10% H2O2溶液 | 两支试管中都未见明显气泡 |
分析 (1)过氧化氢在催化剂存在条件下分解生成氧气和水,据此写出反应的化学方程式;
(2)根据试管A、B实验操作的异同点判断实验目的;氯化铁在双氧水的分解中起到了催化作用;温度越高,H2O2分解速率越快;
(3)b中双氧水的浓度不同,则是探究浓度对H2O2分解速率的影响;在不使用催化剂或加热的条件下双氧水分解很慢,为使实验现象更加明显可以加入等量的氯化铁溶液或同时提高两个试管温度.
解答 解:(1)过氧化氢分解,FeCl3在此反应中作催化剂,起催化作用,能加快过氧化氢分解产生氧气的速率,反应方程式为2H2O2$\frac{\underline{\;氯化铁\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{\;氯化铁\;}}{\;}$2H2O+O2↑;
(2)分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入2 滴1mol/L FeCl3溶液,待试管中均有适量气泡出现,说明过氧化氢分解能发生,试管A、B中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中,将试管B放入盛有40℃左右热水的烧杯中,两支试管不同点是试管A的温度比试管B的温度低,说明研究的是温度对反应速率的影响;开始滴加FeCl3溶液目的是作催化剂,加快H2O2分解速率,使实验现象易于观察;试管A中温度低,无明显气泡产生,试管B中温度高出现大量气泡,说明温度越高,H2O2分解速率越快,
故答案为:探究温度对H2O2分解速率的影响;催化作用(或催化剂);温度越高,H2O2分解速率越快;
(3)b中双氧水的浓度不同,则是探究浓度对H2O2分解速率的影响;在不使用催化剂或加热的条件下双氧水分解很慢,为使实验现象更加明显可以分别在两支试管中加入等量的FeCl3溶液(或将两支试管同时放入盛有相同温度热水的烧杯中),
故答案为:探究浓度对H2O2分解速率的影响;分别在两支试管中加入等量的FeCl3溶液(或将两支试管同时放入盛有相同温度热水的烧杯中).
点评 本题考查了探究影响化学反应速率的因素,题目难度中等,试题侧重考查学生的实验探究能力,明确实验目的为解答关键,注意掌握温度、浓度、催化剂等因素对反应速率的影响.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化钠的电子式: | |
| B. | 丙烷分子的比例模型: | |
| C. | NaHCO3的电离方程式NaHCO3=Na++H++CO32- | |
| D. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图表示球棍模型,小球表示原子序数小于10的原子,短线表示化学键,每个原子都到达稳定结构.下列有关说法正确的是( )
如图表示球棍模型,小球表示原子序数小于10的原子,短线表示化学键,每个原子都到达稳定结构.下列有关说法正确的是( )| A. | M分子的所有原子共面 | |
| B. | 0.1mol/L的N溶液中H+的物质的量浓度为0.1mol/L | |
| C. | L 存在同分异构体 | |
| D. | M、L都是烃类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
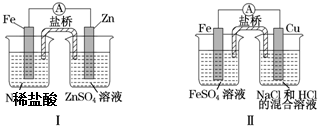
| A. | 装置Ⅰ中铁溶解、锌不溶解,装置Ⅱ中铁溶解、铜不溶解 | |
| B. | 装置Ⅰ中电流表指针不偏转,装置Ⅱ中电流表指针偏转 | |
| C. | 装置Ⅰ和装置Ⅱ中正极反应均是2H++2e-═2H2 | |
| D. | 盐桥中的阳离子均向右侧烧杯移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2 CH2CH3和CH3CH(CH3)2 | B. | CH2=C(CH3)2和CH3CH=CHCH3 | ||
| C. | CH3CH2OH和CH3OCH3 | D. | CH3CH2COOH 和CH3COOCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Th元素的质量数是232 | B. | Th 元素的相对原子质量是231 | ||
| C. | 232Th 转化成 233U是化学变化 | D. | 230Th和 232Th的化学性质相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
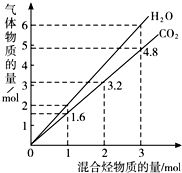 两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是( )| A. | ②⑤⑥ | B. | ②⑥ | C. | ②④ | D. | ②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com