
| A.HNO3溶液 | B.HCl溶液 | C.H2SO4溶液 | D.NaOH溶液 |
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源:不详 题型:填空题
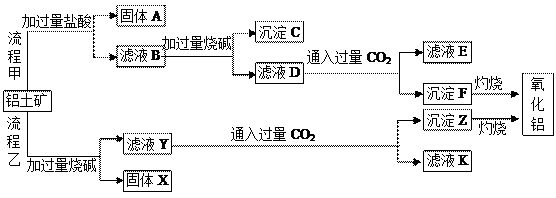
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
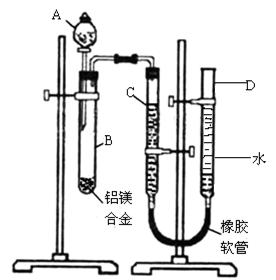
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:1 | B.2:3 | C.3:2 | D.1:6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
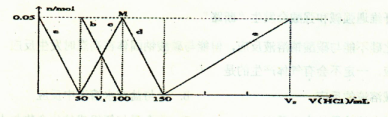
| A.原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 |
| B.V1:V2=1:5 |
| C.M点时生成的CO2为0.05mol |
| D.a曲线表示的离子方程式为:AlO2-+H++H2O=Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.100mL | B.150mL | C.200mL | D.300mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.5mol | B.3mol | C.b/2mol | D.5b/3mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com