
| ①H2SO4溶液中HSO4- | ②NaHSO4溶液中HSO4- | ③CH3COOH | ④HCl溶液 |
| 10% | 29% | 1.33% | 100% |
分析 (1)等pH的酸,其电离程度越大,酸的物质的量浓度越小;
(2)等pH的酸,其电离程度越大,酸的物质的量浓度越小,等体积时浓度越大,产生的氢气的体积越大;
(3)根据盐类的水解考虑溶液的酸碱性,然后根据指示剂的变色范围与酸碱中和后的越接近越好,且变色明显(终点变为红色),溶液颜色的变化由浅到深容易观察,而由深变浅则不易观察;终点时生成的是醋酸钠,醋酸钠溶液中氢氧根离子为水电离的,根据溶液的pH计算出溶液中氢氧根离子的浓度;
(4)当b=0.01mol/L时,反应生成HCN,溶液显示酸性,如果溶液为中性,则KCN应该过量;据电离常数公式求出HCN的电离常数.
解答 解:(1)等pH的酸,其电离程度越大,则需要的酸的物质的量浓度越小,根据表中数据可知,电离程度大小为:③<②<④<①,则物质的量浓度由大到小的顺序是③>②>④>①;
故答案为:③>②>④>①;
(2)等体积pH=1的上述几种溶液中,酸中能够产生氢气的氢原子的物质的量由大到小的顺序为:③②①④,则生成氢气的体积由大到小为:③>②>①>④,
故答案为:③>②>①>④;
(3)NaOH溶液滴和CH3COOH溶液反应恰好完全时,生成了CH3COONa,CH3COONa水解溶液呈碱性,应选择碱性范围内变色的指示剂:酚酞;
滴定终点是,溶液中的溶质为醋酸钠,醋酸钠溶液中的氢氧根离子是水电离的,溶液的pH=a,则溶液中水电离的氢离子=溶液中氢氧根离子浓度=10(a-14)mol/L,
故答案为:酚酞;10(a-14)mol/L;
(4)KCN+HCl═KCl+HCN,若是等浓度,生成HCN应该呈酸性,而反应后PH=7呈中性,说明KCN有剩余(KCN水解呈碱性),所以b>0.01mol/L;
HCN═H++CN-Ka=c(H+)×c(CN-)/c(HCN),溶液呈中性则[H+]=10-7 mol/L,根据电荷守恒可知:c(CN-)+c(Cl-)=c(K+),则c(CN-)=c(K+)-c(Cl-)=$\frac{b-0.01}{2}$mol/L(等体积混合,原浓度都减半),根据物料守恒可得:c(HCN)=$\frac{b}{2}$mol/L-$\frac{b-0.01}{2}$mol/L=$\frac{0.01}{2}$mol/L,带入公式可得:Ka=$\frac{1{0}^{-7}×\frac{b-0.01}{2}}{\frac{0.01}{2}}$=(100b-1)×10-7 mol•L-1,
故答案为:>;(100b-1)×10-7 mol•L-1.
点评 本题考查了酸碱混合的定性判断、溶液中离子浓度定性、电离平衡常数的计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,能够根据电荷守恒、盐的水解判断溶液中离子浓度定性,(4)为难点,注意正确分析、理解题干信息,结合电离平衡常数的表达式进行计算.


科目:高中化学 来源: 题型:选择题
| A. | 四种元素的最简单气态氢化物中W的沸点最高 | |
| B. | W、X、Y、Z的简单阴离子都会促进水的电离 | |
| C. | 原子的半径:Y>Z>W>X | |
| D. | YX2、YX3通入BaCl2溶液中均有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
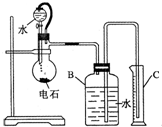 某同学设计如图所示的实验装置来粗略测定电石中碳化钙的质量分数.
某同学设计如图所示的实验装置来粗略测定电石中碳化钙的质量分数.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
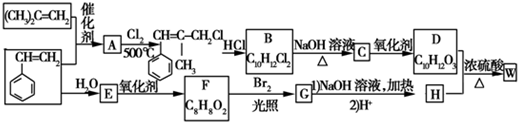
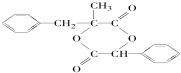 .
. ;由D生成高分子化合物的方程式为
;由D生成高分子化合物的方程式为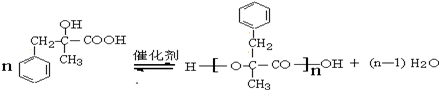 .
.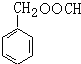 (写结构简式),其峰面积之比为1:2:2:2:1.
(写结构简式),其峰面积之比为1:2:2:2:1.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
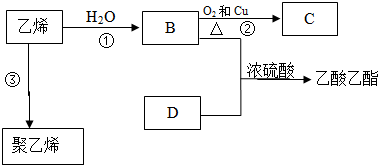
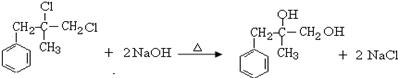
 .
. ,反应类型:加聚反应.
,反应类型:加聚反应. 
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
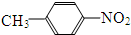 和
和 E、35Cl和37Cl
E、35Cl和37Cl查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
| SO2 | O2 | SO3 | Ar | ||
| 甲 | 4 | 2 | 0 | 0 | 放出热量:Q1 |
| 乙 | 3 | 1.5 | 1 | 0 | 放出热量:Q2 |
| 丙 | 3 | 1.5 | 1 | 0.1 | 放出热量:Q3 |
| A. | Q1=Q2=Q3=394 kJ | |
| B. | 若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1<-197 kJ•mol-1 | |
| C. | 甲、乙、丙3个容器中反应的平衡常数不相等 | |
| D. | 达到平衡时,丙容器中SO2的体积分数最大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com