

| A.反应开始2 min内平均反应速率最大 |
| B.反应速率先增大后又减小 |
| C.反应开始4 min内温度对反应速率的影响比浓度大 |
| D.反应在第2 min到第4 min间生成CO2的平均反应速率为v(CO2)=0.1 mol·min-1 |
科目:高中化学 来源:不详 题型:单选题
 4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )A.该反应的化学平衡常数表达式是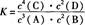 |
| B.此时,B的平衡转化率是35% |
| C.增大该体系的压强,平衡向右移动,化学平衡常数增大 |
| D.增大C,B的平衡转化率不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标况下) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.催化剂只改变反应的正反应速率 |
| B.催化剂通过升高反应的活化能来加快反应速率 |
| C.催化剂能够改变反应的反应热 |
| D.催化剂不能改变反应物的转化率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将大小、形状相同的镁条和铝条与相同浓度、相同温度下的盐酸反应时,两者快慢相同 |
| B.盛有相同浓度双氧水的两支试管,一支加入MnO2放在冷水中,一支直接放在冷水中,前者反应快 |
| C.将浓硝酸分别放在冷暗处和强光下,发现强光下的浓硝酸分解得快 |
| D.升高温度,H2O2的分解速率加快,原因是反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g) ΔH=-92.4kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是( )
2NH3(g) ΔH=-92.4kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是( )
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应达到最大限度时,正逆反应速率也达到最大且相等 |
| B.催化剂能降低化学反应的活化能,加快反应速率,提高生产效率 |
| C.用锌和稀硫酸反应制取H2时,滴加几滴硫酸铜溶液能加快反应速率 |
| D.用铁片和稀硫酸反应制H2比用98%的浓硫酸产生H2的速率快 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.粉末状态的煤比块状煤的着火点低 |
| B.粉末状态的煤比块状煤放出的热量多 |
| C.粉末状态的煤比块状煤的总表面积大 |
| D.粉末状态的煤呈气态,属于可燃性气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com