
【题目】砷(As)元素及其化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)基态As原子的核外电子排布式为_____,砷与硒的第一电离能较大的是_____。
(2)传统中药的砷剂俗称“砒霜”,其分子结构如图所示,该化合物中As、O原子的杂化方式分别为____、_____。

(3)Na3AsO4可作杀虫剂。![]() 的立体构型为____,与其互为等电子体的分子的化学式为_____(任写一种)。
的立体构型为____,与其互为等电子体的分子的化学式为_____(任写一种)。
(4)H3AsO4和H3AsO3是砷的两种含氧酸,请根据物质结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因_____。
【答案】1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3 As 或砷 sp3杂化 sp3杂化 正四面体形 CF4或 SiF4、CCl4、SiCl4 H3AsO4 和 H3AsO3 可分别表示为(HO)3AsO 和(HO)3As,H3AsO3 中 As 为+3 价,而 H3AsO4 中 As为+5 价,正电性更高,导致 As—O—H 中 O 的电子向 As 偏移,更易电离出 H+
【解析】
(1)As是33号元素,位于第四周期第VA族,据此书写基态As原子核外电子排布式;同周期中第一电离能第ⅤA族>第ⅥA族,据此判断;
(2)根据图片知,每个As原子能形成3个共价键、每个O原子能形成2个共价键,根据价层电子对互斥理论确定原子杂化方式;
(3)AsO43-中,成键数为4,孤对电子数为(5+3-2×4)× ![]() =0,为sp3杂化;等电子体的原子数和价电子数(或电子总数)相同;
=0,为sp3杂化;等电子体的原子数和价电子数(或电子总数)相同;
(4)比较非羟基氧的多少,结合As原子化合价判断,非羟基氧越多、As化合价越高则酸性越强。
(1)As是33号元素,位于第四周期第VA族,基态As原子核外电子排布式为1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3;同周期电离能第ⅤA族>第ⅥA族,所以砷的第一电离能大于硒,故答案为:1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3;砷;
(2)根据分子结构可知,分子内含有6个氧原子,4个砷原子,化学式为As4O6,每个As原子形成3个共价键,又因为中心原子As上还有1对孤电子对,所以采用sp3杂化,每个O原子形成2个共价键,又因为中心原子O上还有2对孤电子对,所以采用sp3杂化,故答案为:sp3杂化;sp3杂化;
(3)AsO43-中As原子价层电子数为4+![]() =4、含有的孤电子对数是0,所以其构型是正四面体形,AsO43-中含有5个原子,32个价电子,所以与其互为等电子体的一种分子为CF4、SiF4、CCl4、SiCl4等,故答案为:正四面体; CF4或SiF4、CCl4、SiCl4;
=4、含有的孤电子对数是0,所以其构型是正四面体形,AsO43-中含有5个原子,32个价电子,所以与其互为等电子体的一种分子为CF4、SiF4、CCl4、SiCl4等,故答案为:正四面体; CF4或SiF4、CCl4、SiCl4;
(4)H3AsO4和H3AsO3可分别表示为(HO)3AsO和(HO)3As,H3AsO3中的As为+3价,而H3AsO4中非羟基氧较多、As为+5价,正电性更高,导致As-O-H中的O的电子向As偏移,更易电离出H+,故答案为:H3AsO4和H3AsO3可表示为(HO)3AsO和(HO)3As,H3AsO3中的As为+3价,而H3AsO4中非羟基氧较多、As为+5价,正电性更高,导致As-O-H中的O的电子向As偏移,更易电离出H+。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】已知X为Fe2O3和CuO的混合物且氧化性强弱顺序:Fe3+>Cu2+>H+>Fe2+。X样品可发生如图所示的转化关系:

(1)写出步骤③可能发生反应的离子方程式:________________________(共有3个,任写一个即可)。
(2)若溶液E中只有一种金属离子,则一定是__________;若溶液E中含有两种金属离子,则一定是________。
(3)若D固体是纯净物,该固体是________(填化学式)。
(4)印刷电路板是由高分子材料和铜箔复合而成的,可用FeCl3溶液作“腐蚀剂”刻制印刷电路板,该过程发生反应的离子方程式为____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)![]() Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】数10亿年来,地球上的物质不断变化,大气的成分也发生了很大的变化。下表是原始大气和目前空气的主要成分:

用上表所涉及的分子填写下列空白。
(1)含有10个电子的分子有(填化学式,下同)______________;
(2)由极性键构成的非极性分子有____________________;
(3)与H+可直接形成配位键的分子有________;
(4)沸点最高的物质是________,用所学的知识解释其沸点最高的原因________;
(5)分子中不含孤电子对的分子(稀有气体除外)有________,它的立体构型为________;
(6)极易溶于水、且水溶液呈碱性的物质的分子是________,它之所以极易溶于水是因为它的分子和水分子之间形成________;
(7)CO的结构可表示为O![]() C,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
C,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某核素 ZAX可形成HmX型氢化物,则a g HmX 含有 ( )
A.![]() (A-Z+m)mol中子B.
(A-Z+m)mol中子B.![]() mol电子
mol电子
C.![]() (Z+m) mol质子D.
(Z+m) mol质子D.![]() mol HmX分子
mol HmX分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种优良的消毒剂,熔点为-59 ℃,沸点为 11 ℃,浓度过高时易发生分解,甚至爆炸。二氧化氯具有强刺激性和腐蚀性。某课外兴趣小组通过氯气与 NaClO2溶液反应来制取少量ClO2,装置如图所示:
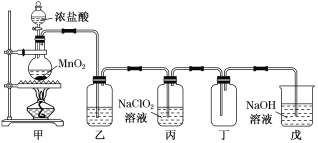
(1)甲装置中圆底烧瓶内发生反应的化学方程式是______________________________________。
(2)Cl-存在时会催化 ClO2的生成,若无乙装置,则丙装置内产生 ClO2的速率明显加快。乙装置中试剂瓶内的液体是__________。实验过程中常需通入适量的 N2稀释 ClO2,其目的是_____________________________________________。
(3)丙装置中发生的反应为:Cl2+2NaClO2===2ClO2↑+2NaCl 。
下列有关该实验的说法正确的是________________
A. 可用微热法检查实验装置的气密性
B. 如果乙装置是盛有浓硫酸,更有利于实验安全
C. 若甲中足量MnO2与含0.4 molHCl的浓盐酸反应,则丙中可制得0.2molClO2
D. 实验过程甲装置要缓缓加热,不宜强热
(4)戊装置烧杯中NaOH 溶液,其作用是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢.
(1)A的结构简式为___________; A中的碳原子是否都处于同一平面?____(填“是”或“不是”);
(2) 在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体.

反应②的化学方程式为__________________________;E2的结构简式是___________________;④、⑥的反应类型依次是________________________、__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是 ( )

A. 加热装置I中的烧杯分离I2和高锰酸钾固体
B. 用装置II验证二氧化硫的漂白性
C. 用装置III制备氢氧化亚铁沉淀
D. 用装置IV检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1],下列说法正确的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1],下列说法正确的是( )
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、 3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓 度/mol·L-1 | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A. 2c1>c3B. α1+α3<1C. 2p2<p3D. a+b>92.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com