
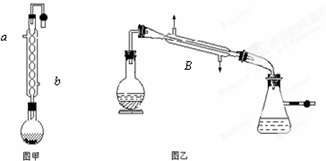
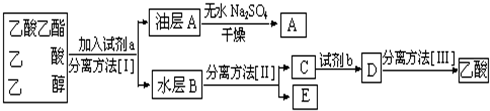


科目:高中化学 来源: 题型:
| A、25°时,有pH=a的醋酸溶液,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| B、向2.0mL浓度均为0.1mol?L-1的KCl、KI混合液滴加1~2滴0.01 mol?L-1AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp小 |
| C、0.2mol/L的一元酸HX与0.1mol/L的KOH溶液等体积混合所得溶液中,一定有:c(H+)+c(K+)═c(OH-)+c(X-) |
| D、25°时,0.2mol?L-1盐酸与等体积0.05mol?L-1Ba(OH)2溶液混合后,溶液pH为1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓硫酸 |
| 加热 |
| 化合物 | 密度/g?cm-3 | 沸点/℃ | 溶解度/g |
| 正丁醇 | 0.810 | 118.0 | 9 |
| 冰醋酸 | 1.049 | 118.1 | ∞ |
| 乙酸正丁酯 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
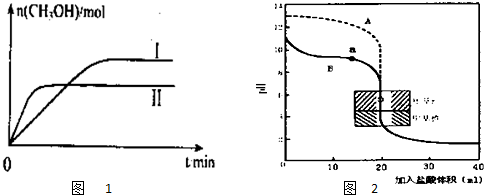
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
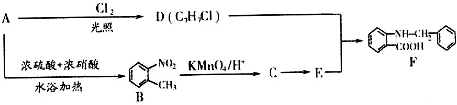
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com