
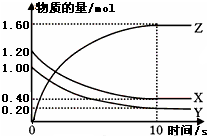
 (1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
(1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则| △c |
| △t |
 2Z,
2Z, 2Z;
2Z;
| ||
| 10s |
| 0.8mol |
| 1.2mol |


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| A、在常温常压下,14 gN2含有的分子数为0.5NA |
| B、50 mL1 mol/L的Na2SO4溶液中含Na+数为NA |
| C、标准状况下,22.4 L H2和O2的混合气体所含分子数为NA |
| D、24 g Mg与盐酸充分反应转移电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
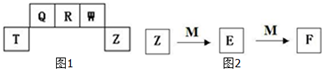 短周期元素T、Q、R、W、Z在元素周期表中的位置如图1所示,其中T所处的周期序数与主族序数相等,请用相关化学用语回答下列问题:
短周期元素T、Q、R、W、Z在元素周期表中的位置如图1所示,其中T所处的周期序数与主族序数相等,请用相关化学用语回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AB的电离是吸热过程 |
| B、在35℃时,c(A+)>c(B-) |
| C、AB的电离程度(25℃)>(35℃) |
| D、c(A+)随温度升高而降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去乙酸乙酯中的少量乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯 |
| B、混入Cl2中的HCl气体,可用饱和NaCl溶液除去 |
| C、除去Fe粉中的少量铝粉:加入NaOH溶液后过滤 |
| D、提取溶解在水中的少量溴:加入CCl4,振荡,静置,分层后,取出有机层再分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、E2 |
| B、E2-E1 |
| C、E3-E2 |
| D、E3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有大量ClO-的溶液:Na+、OH-、I-、SO32- |
| B、澄清透明的溶液:Cu2+、Fe3+、NO3-、Cl- |
| C、使pH试纸变蓝的溶液:NH4+、K+、S2-、CO32- |
D、c(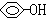 )=0.1mol/L的溶液:Na+、Cl-、CO32-、NO3- )=0.1mol/L的溶液:Na+、Cl-、CO32-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com