
分析 ①2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O方程中+7价锰元素化合价降为+2价,-1价氯元素化合价升高为0价,参加反应的氯化氢有16mol,只有10mol化合价升高,据此解答;
②反应中高锰酸钾中+7价锰元素化合价降为硫酸锰中+2价,过氧化氢中-1价氧化化合价升高为氧气中0价氧,依据氧化还原反应得失电子守恒、原子个数守恒写出反应方程式.
解答 解:①2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O方程中+7价锰元素化合价降为+2价,-1价氯元素化合价升高为0价,参加反应的氯化氢有16mol,只有10mol化合价升高,用双线桥表示为: ,
,
故答案为: ;
;
②反应中高锰酸钾中+7价锰元素化合价降为硫酸锰中+2价,过氧化氢中-1价氧化化合价升高为氧气中0价氧,要使得失电子守恒则两者的最小公倍数为10,所以高锰酸钾前面的系数为2,过氧化氢前面的系数为5,然后根据物料守恒得其它物质前面的系数,方程式为:2KMnO4+5H2O2+3H2SO4-1K2SO4+2MnSO4+5O2↑+8H2O;
故答案为:2;5;3;1;2;5;8.
点评 本题考查氧化还原反应的双线桥表示、氧化还原反应的配平,侧重于学生的分析能力的考查,为高频考点,注意把握元素化合价的变化,能会用双线桥法表示电子转移的方向和数目,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在溴乙烷中直接加入AgNO3溶液 | |
| B. | 加蒸馏水,充分搅拌后,加入AgNO3溶液 | |
| C. | 加入NaOH的乙醇溶液,加热后加入AgNO3溶液 | |
| D. | 加入NaOH溶液加热,冷却后加入稀硝酸酸化,然后加入AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验组 | 温度℃ | 起始量mol | 平衡量mol | 达平衡所需时间min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铝熔点高达2045℃,可用于制成坩埚熔化氢氧化钠固体 | |
| B. | HF可以用于刻蚀玻璃 | |
| C. | 镁铝合金可用作制造飞机的材料 | |
| D. | 过氧化钠可用作供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/(g/100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
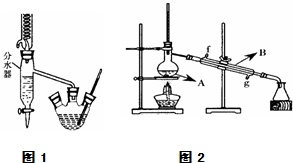
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
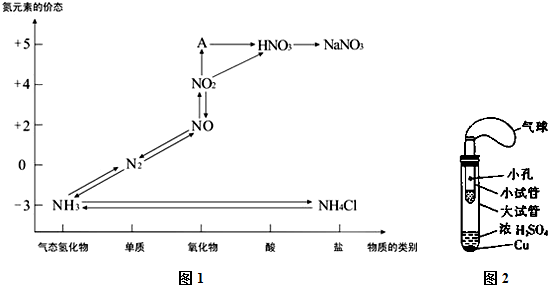
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
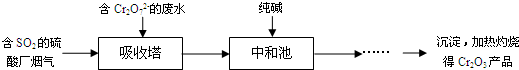
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com