
已知CO(g)+H2O(g) CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的△H__________0(填“<”“>”“=”);
(2)830℃时,向一个5L的密闭容器中充入0.20mol的CO和0.80mol的H2O,反应初始6s内CO的平均反应速率v(CO)=0.003mol•L-1•s-1,则6S末CO2的物质的量浓度为__________;反应经一段时间后,达到平衡后CO的转化率为__________;
(3)判断该反应是否达到平衡的依据为_______(填正确选项前的字母);
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(CO)不随时间改变 d.单位时间里生成CO和H2的物质的量相等
(4)已知1000℃时,要使CO的转化率超过90%,则起始物c(H2O):c(CO)应不低于__________;
(5)已知CO可用于制备很多物质:
2CO(g)+SO2(g)═S(g)+2CO2(g)△H=+8.0kJ•mol-1
2H2(g)+SO2(g)═S(g)+2H2O(g)△H=+90.4kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H=-556.0kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
请写出S(g)与O2(g)反应生成SO2(g)热化学方程式_______________;
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年湖南省高二下期中理科化学试卷(解析版) 题型:选择题
对相同状况下的12C18O和14N2两种气体,下列说法正确的是
A.若质量相等,则质子数相等
B.若原子数相等,则中子数相等
C.若分子数相等,则体积相等
D.若体积相等,则密度相等
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏银川二中高二下期中化学试卷(解析版) 题型:选择题
某有机物的分子式为C5H8O,就其结构来说,该有机物不可能是
A.含两个双键的链状化合物
B.只含一个三键的链状化合物
C.只含—个双键的链状化合物
D.只含一个双键的环状化合物
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三5月模拟考试理综化学试卷(解析版) 题型:实验题
某学习小组研究溶液中Fe2+的稳定性;进行如下实验,观察,记录结果。
实验I
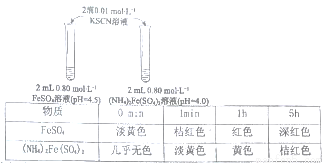
(1)上述(NH4)2Fe(SO4)2溶液pH小于FeSO4的原因是_____________(用化学用语表示)。溶液的稳定性:FeSO4_______(NH4)2Fe(SO4)2(填“>”或“<”)。
(2)甲同学提出实验I中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+有还原性,进行实验Ⅱ,否定了该观点,补全该实验。

(3)乙同学提出实验I中两溶液的稳定性差异是溶液酸性不同导致,进行实验Ⅲ;分别配制0.80mol•L-1pH为1、2、3、4的FeSO4溶液,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
资料显示:亚铁盐溶液中存在反应 4Fe2++O2+10H2O 4Fe(OH)3+8H+ 由实验Ⅲ,乙同学可得出的结论是_________,原因是_________。
4Fe(OH)3+8H+ 由实验Ⅲ,乙同学可得出的结论是_________,原因是_________。
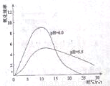
(4)进一步研究在水溶液中Fe2+的氧化机理,测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如图(实验过程中溶液温度几乎无变化)。反应初期,氧化速率逐渐增大的原因可能是_________。
(5)综合以上实验,增强Fe2+稳定性的措施有_________。
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三5月模拟考试理综化学试卷(解析版) 题型:选择题
化学在生产和日常生活中有着重要的应用。下列叙述正确的是
A.白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去
B.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料
C.SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾
D.“雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西吉安一中高二下第二次段考化学试卷(解析版) 题型:选择题
甘草甜素在治疗丙肝、或艾滋病、非典等疾病方面有一定疗效。甘草甜素在一定条件下可转化为甘草次酸.下列有关说法正确的是
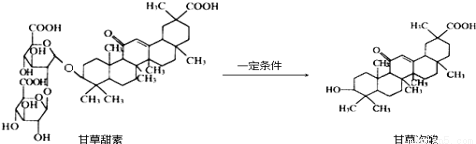
A.甘草甜素转化为甘草次酸属于酯的水解
B.在Ni催化作用下,1mol 甘草次酸最多能与3molH2发生加成反应
C.甘草甜素中含有羧基、羰基、碳碳双键、酚羟基等官能团
D.甘草甜素、甘草次酸均可与Na2CO3、溴水等无机试剂发生反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西吉安一中高二下第二次段考化学试卷(解析版) 题型:选择题
在下列溶液中,能大量共存的一组离子是
A.pH=1的溶液中,NH4+、Fe3+、SO42-、Cl-
B.通入过量SO2气体的溶液中:Fe3+、NO3-、Ba2+、H+
C.c(Al3+)=0.1mol/L的溶液中:Na+、K+、AlO2-、SO42-
D.由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、HCO3-、Cl-、Br-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高二下期中化学试卷(解析版) 题型:选择题
甲醛(H2C=O)在Ni催化作用下加氢可得到甲醇(CH3OH),以下说法中正确的是
A.甲醇、甲醛分子间都可以形成氢键
B.甲醇分子内C原子采取sp2杂化,O原子采取sp杂化
C.甲醛为极性分子,分子中两个C—H键夹角小于120°
D.甲醇分子内的O—C—H键角大于甲醛分子内的O—C—H键角
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三模拟押题理综化学试卷(解析版) 题型:实验题
NCl3可用于漂白,也可用于柠檬等水果的熏蒸处理。已知:NCl3熔点为-40℃,沸点为70℃,95℃以上易爆炸,有刺激性气味,可与水反应。实验室中可用氯气和氨气反应制取NCl3,反应方程式为4NH3+3C12===NCl3+3NH4Cl。某校化学兴趣小组同学设计了如图所示的实验装置(NH4Cl的分解温度为300℃左右)。
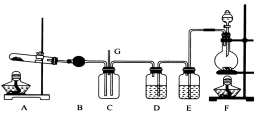
回答下列问题:
(1)写出装置F中的烧瓶内发生反应的离子方程式:___________________________。
(2)E中的试剂为__________________。
(3)导管G末端应连接的装置为下图中的___________(填选项字母)。
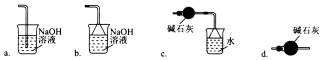
(4)NCl3遇水可发生水解反应生成两种物质,其中一种是可使湿润的红色石蕊试纸变蓝的气体,写出NCl3水解的化学方程式:_______________。
(5)已知C中生成的NH4Cl溶解在NCl3中,欲将二者分离可采取的操作方法为_____________________。
(6)NH4Al(SO4)2也可用于自来水的净化。
①NH4Al(SO4)2溶液中离子浓度由大到小的顺序为_________________。
②向NH4Al(SO4)2溶液中滴加氨水至溶液呈中性,在此过程中水的电离程度_________(填“增大”“减小”或“不变”)。
③常温下,将a mol NH4Al(SO4)2:加入到b L c mol/L的氨水中,所得溶液呈中性,此时溶液中c(Al3+)≈0 mol/L,计算该温度下NH3·H2O的电离常数___________(用含字母的代数式表示,忽略溶液体积变化)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com