
【题目】25 ℃时,用 2a molL-1 NaOH 溶液滴定 1.0 L 2a molL-1 氢氟酸溶液,得到混合液中 HF、F-的物质的量与溶液 pH 的变化如图所示。下列说法正确的是( )

A. pH=3 时,溶液中: c(Na+)>c(F-)
B. c(F-)>c(HF)时,溶液一定呈碱性
C. pH=4 时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)< 2a molL-1
D. pH=3.45 时,NaOH 溶液恰好与 HF 完全反应
【答案】C
【解析】
试题分析:A.pH=3时,c(H+)>c(OH-),溶液中存在c(Na+)+c(H+)=c(OH-)+c(F-),则c(F-)>c(Na+),故A错误;B.当pH>3.45时,c(F-)>c(HF),溶液可能呈酸性、中性或碱性,故B错误;C.当pH=4时,混合溶液体积大于1.0L,c(F-)<1.6amol/L,c(HF)<0.4amol/L,溶液中存在c(Na+)+c(H+)=c(OH-)+c(F-),c(F-)=c(Na+)+c(H+)-c(OH-)<1.6amol/L,则c(HF)+c(Na+)+c(H+)-c(OH-)<2amolL-1,故C正确;D.HF为弱酸,恰好反应时溶液应成碱性,当pH=3.45时HF酸过量,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】化学反应常伴随着颜色变化,下列现象描述不正确的是
A.无色一氧化氮气体与空气接触变为红棕色
B.往淀粉溶液中滴加碘水,溶液显蓝色
C.向硫酸铜溶液中滴加氢氧化钠溶液,出现白色沉淀
D.将足量二氧化硫气体通入品红溶液,红色逐渐褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某非金属单质A和氧气发生化合反应生成B。B为气体,其体积是反应掉氧气体积的两倍(同温同压)。以下对B分子组成的推测一定正确的是
A.有1个氧原子
B.有2个氧原子
C.有1个A原子
D.有2个A原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氧化还原反应的下列说法中正确的是( )
A.氧化还原反应前后元素化合价没有升降
B.氧化还原反应前后一定有氧的得失
C.氧化还原反应前后一定有电子转移
D.复分解反应和化合反应一定是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于密闭容器中可逆反应 A2(g)+3B2(g)![]() 2AB3(g),探究单一条件改变情况下,可能引起平衡状态的改变,得到如下图所示的曲线(图中T表示温度,n 表示物质的量)下列判断正确的是( )
2AB3(g),探究单一条件改变情况下,可能引起平衡状态的改变,得到如下图所示的曲线(图中T表示温度,n 表示物质的量)下列判断正确的是( )

A.加入催化剂可以使状态 d 变为状态 b
B.若 T1>T2,则逆反应一定是放热反应
C.达到平衡时 A2 的转化率大小为: b>a>c
D.在T2 和n(A2)不变时达到平衡,AB3 的物质的量大小为: c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A. 食醋中含有乙酸,乙酸可由乙醇氧化得到
B. 乙醇、乙酸乙酯、乙酸能用饱和碳酸钠溶液鉴别
C. 乙酸、乙酸乙酯、葡萄糖和淀粉的最简式相同
D. 生活中食用的食醋、植物油、动物蛋白等都是混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L某混合溶液中可能含有的离子如下表:
可能大量含有的阳离子 | H+、NH4+ 、Al3+、K+ |
可能大量含有的阴离子 | Cl﹣、Br﹣、I﹣、ClO﹣、AlO2﹣ |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如图所示.
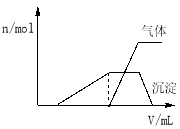
①则该溶液中确定含有的离子有 ;
②不能确定是否含有的阳离子有 ;
③要确定其存在可补充做的实验是 ;
④肯定不存在的阴离子有 .
(2)经检测,该溶液中含有大量的Cl﹣、Br﹣、I﹣,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl﹣、Br﹣、I﹣的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
n(Cl﹣) | 1.25mol | 1.5mol | 2mol |
n(Br﹣) | 1.5mol | 1.4mol | 0.9mol |
n(I﹣) | a mol | 0 | 0 |
①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为 .
②原溶液中Cl﹣、Br﹣、I﹣的物质的量浓度之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50mol/LNaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol/LNaOH溶液
若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体___________g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。

取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
(1)写出该反应的热化学方程式为___________(中和热为57.3kJ/mol);
(2)①请填写下表中的空白:

②近似认为0.50mol/LNaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g℃)。则中和热△H=___________(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是___________(填字母)
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com