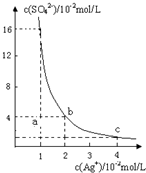
某温度时,Ag
2SO
4在水溶液中的沉淀溶解平衡曲线如图所示:
(1)a点表示Ag
2SO
4不饱和
不饱和
(填“饱和”或“不饱和”) 溶液;
(2)b点对应的K
sp=
=
d点对应的K
sp(填“<”、“>”或“=”);
(3)现将足量的Ag
2SO
4分别放入:
a.40mL 0.01mol?L
-1 K
2SO
4溶液,b.10mL蒸馏水;
c.10mL 0.02mol?L
-1H
2SO
4溶液;
则Ag
2SO
4的溶解度由大到小的排列顺序为
b>a>c
b>a>c
(填字母)
(4)下列有关Ag
2SO
4说法正确的是
BC
BC
A.含有大量SO
42-的溶液中肯定不存在Ag
+B.Ag
2SO
4的溶度积常数(Ksp)为1.6×10
-5 (mol?L
-1)
3C.0.02mol?L
-1的AgNO
3溶液与0.2mol?L
-1的Na
2SO
4溶液等体积混合不会生成沉淀
(5)往Ag
2SO
4溶液中加入足量的Na
2CrO
4固体,可观察到砖红色沉淀(Ag
2CrO
4为砖红色),写出沉淀转化的离子方程式
Ag2SO4+CrO42-?Ag2CrO4+SO42-
Ag2SO4+CrO42-?Ag2CrO4+SO42-
.

 某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示:
某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示:
