
【题目】100mL 0.3mol/L Na2SO4溶液和50mL0.2mol/L Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度约为(不考虑混合后溶液体积的变化)
A.0.20mol/LB.0.25mol/LC.0.40mol/LD.0.50mol/L
科目:高中化学 来源: 题型:
【题目】为测定某样品中碳酸氢钠的质量分数(假设仅含杂质氯化钠),某学生设计了如下实验方案:
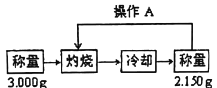
(1)称量所需要的仪器是_______________;
(2)样品放在_________(仪器名)中灼烧,在_________(仪器名)中冷却;
(3)实验中操作A的名称为_______________;
(4)灼烧后的样品若在空气中冷却,会造成实验结果_______(填“偏大”、“偏小”或“不变”);
(5)样品中碳酸氢钠的质量分数为_________(保留3位有效数字)。已知该样品碳酸氢钠的质量分数为0.800,则本次实验的相对误差为___________;
(6)将灼烧后的样品加足量稀硫酸溶解,生成的气体在标准状况下的体积为_____毫升(按碳酸氢钠质量分数0.800计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列行为不符合安全要求的是![]()
![]()
A.做实验剩余的金属钠放回原试剂瓶中
B.闻气体时用手轻轻扇动,使少量气体飘进鼻孔
C.金属钠着火时使用泡沫灭火器灭火
D.装氢氧化钠溶液的试剂瓶用橡胶塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。下列有关说法正确的是( )
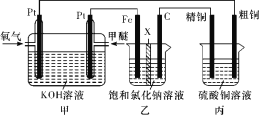
A.通入甲醚的一极为负极,发生的电极反应为:CH3OCH3-12e-+16OH- =2CO32-+11H2O
B.乙装置中铁电极为阴极,电极反应式为Fe-2e-= Fe2+
C.反应一段时间后,乙装置中生成的氢氧化钠在石墨极区
D.反应一段时间后,丙装置中硫酸铜溶液浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某黄酮类药物的合成涉及反应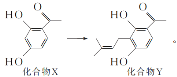 下列说法正确的是( )
下列说法正确的是( )
A.化合物X在空气中能稳定存在
B.化合物X中所有碳原子可处于同一平面
C.化合物X、Y都可与溴水发生加成反应
D.1mol化合物Y最多可以与4molH2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) △H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线。下列说法不正确的是
H2O(g)+CH3OH(g) △H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线。下列说法不正确的是
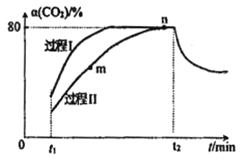
A. m点:v(正)>v(逆)
B. 活化能:过程Ⅱ>过程I
C. n点时该反应的平衡常数K=50
D. 过程I,t2时刻改变的反应条件可能是升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效去除大气中的H2S、SO2以及废水中的硫化物是环境保护的重要课题。
(1)去除废气中H2S的相关热化学方程式如下:
2H2S(g)+3O2(g)=2H2O(l)+2SO2(g);ΔH=akJ·mol-1
2H2S(g)+SO2(g)=2H2O(l)+3S(s);ΔH=bkJ·mol-1
反应2H2S(g)+O2(g)=2H2O(l)+2S(s)的ΔH=__kJ·mol-1。
为了有效去除废气中的H2S,在燃烧炉中通入的H2S和空气(O2的体积分数约为20%)体积比一般控制在0.4,理由是__。
(2)电化学氧化法是一种高效去除废水中硫化物的方法,电解NaHS溶液脱硫的原理如图1所示。碱性条件下,HS-首先被氧化生成中间产物Sn2-,S n2-容易被继续氧化而生成硫单质。
①阳极HS-氧化为S n2-的电极反应式为___。
②电解一段时间后,阳极的石墨电极会出现电极钝化,导致电极反应不能够持续有效进行,其原因是___。

(3)用CO(NH2)2(N为-3价)水溶液吸收SO2,吸收过程中生成(NH4)2SO4和CO2。该反应中的氧化剂是__。
(4)在一定条件下,CO可以去除烟气中的SO2,其反应原理为2CO+SO2=2CO2+S。其他条件相同、以比表面积大的γ—Al2O3作为催化剂,研究表明,γ—Al2O3在240℃以上发挥催化作用。反应相同的时间,SO2的去除率随反应温度的变化如图2所示。240℃以前,随着温度的升高,SO2去除率降低的原因是__。240℃以后,随着温度的升高,SO2去除率迅速增大的主要原因是__。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
B.将大理石投入到足量盐酸中:CO32-+2H+=CO2↑+H2O
C.将Cl2通入KI溶液中:2I-+Cl2=2Cl-+I2
D.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3+ +3H2O![]() Fe (OH)3↓+ 3H+
Fe (OH)3↓+ 3H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com