
A.检验亚硫酸钠试样是否变质: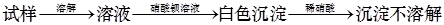 |
B.除去乙酸乙酯中混有的乙酸: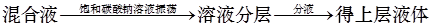 |
C.证明酸性条件下H2O2氧化性比I2强: |
D.鉴定盐A的成分是FeBr2: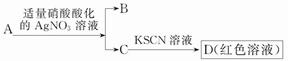 |
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源:不详 题型:实验题
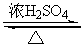 CH3CH2Br+H2O
CH3CH2Br+H2O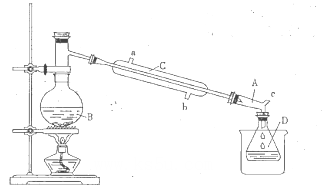
| 物质 | 相对分子质量 | 沸点/℃ | 密度/g/cm3 | 水溶性 |
| CH3CH2OH | 46 | 78.4 | 0.79 | 互溶 |
| CH3CH2Br | 109 | 38.4 | 1.42 | 难溶 |
| CH3CH2OCH2CH3 | 74 | 34.5 | 0.71 | 微溶 |
| CH2=CH2 | 28 | -103.7 | 0.38 | 不溶 |
| 浓硫酸(H2SO4) | 98 | 338.0 | 1.38 | 易溶 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
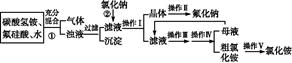
 NH4F+ H2SiO3↓+ CO2↑+
NH4F+ H2SiO3↓+ CO2↑+ 查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| A.萃取、过滤、分液、过滤、蒸发结晶 |
| B.萃取、分液、蒸馏、过滤、蒸发结晶 |
| C.分液、萃取、过滤、过滤、蒸发结晶 |
| D.萃取、分液、分液、过滤、蒸发结晶 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
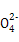 、N
、N 、Cl-中的4种离子,所含离子的物质的量均为1 mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是( )
、Cl-中的4种离子,所含离子的物质的量均为1 mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是( )| A.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72 g |
| B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色 |
| C.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 |
| D.该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.从碘水中提取单质碘时,不能用无水乙醇代替CCl4 |
| B.乙醇发生催化氧化反应,产物可用新制的Cu(OH)2悬浊液检验 |
| C.用浓硫酸与蛋白质的颜色反应鉴别部分蛋白质 |
| D.实验室中提纯混有少量乙酸的乙醇,可采用先加生石灰,过滤后再蒸馏的方法 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
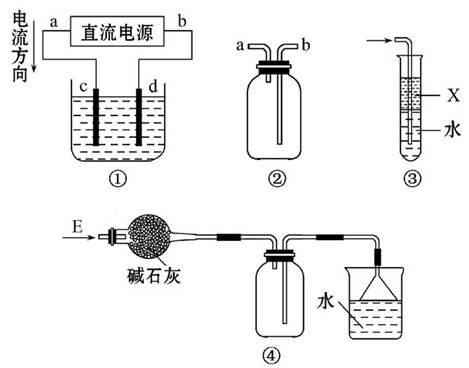
| A.装置①用来电解饱和食盐水,c电极产生的气体能使湿润的淀粉KI试纸变蓝 |
| B.装置②可用于收集H2、NH3、Cl2、HCl、NO2 |
| C.装置③中X为苯,可用于吸收氨气或氯气 |
| D.装置④可用于干燥、收集氨气,并吸收多余的氨气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 实验 小组 | 称取CuSO4 的质量/g | 装置C增加 的质量/g | 量筒中水的体积折算成标准状况下气体的体积/mL |
| 一 | 6.4 | 2.56 | 448 |
| 二 | 6.4 | 2.56 | 224 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
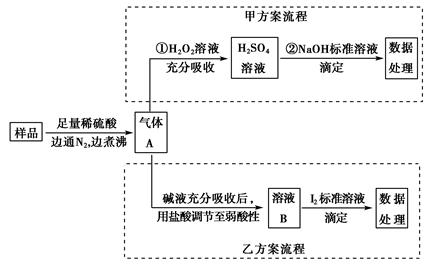
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com