
| A. | 胶体与其他分散系最本质的区别是分散质粒子的直径介于1-100 nm之间 | |
| B. | 胶体和溶液都一定是均一透明的分散系,可以用丁达尔效应来鉴别 | |
| C. | 制备Fe(OH)3胶体的操作为,在沸水中逐滴滴加5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色沉淀,停止加热 | |
| D. | 用过滤的方法可以将胶体和溶液分离 |
分析 A.分散质粒子的大小不同是分散系的本质区别;
B.胶体不一定是透明的分散系;
C.生成的氢氧化铁胶体不是红褐色沉淀;
D.胶体和溶液都能够通过滤纸.
解答 解:A.分散质粒子的大小不同是分散系的本质区别,分散质微粒直径,小于1nm的形成分散系为溶液,大于100nm为浊液,1-100nm的为胶体,故A正确;
B.胶体和溶液都是均一的,可以用丁达尔效应鉴别,但是溶液为透明的,而胶体不一定透明,故B错误;
C.沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热,不能生成红褐色沉淀,故C错误;
D.由于胶体和溶液都能够通过滤纸,不能用过滤方法分离,可以用半透膜分离,故D错误;
故选A.
点评 本题考查了胶体的性质,题目难度不大,明确常见分散系的分类依据为解答关键,注意掌握溶液与胶体的区别,试题培养了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题
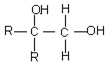 $\stackrel{氧化}{→}$
$\stackrel{氧化}{→}$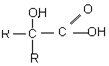

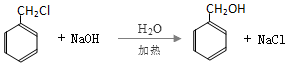 ;
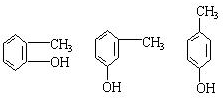
;
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
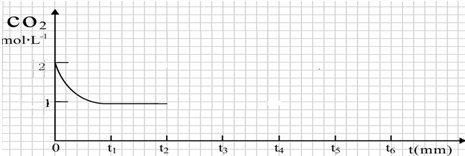
| 反应条件 | 反应时间 | CO2 (mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 恒温恒容 (T1℃、2L) | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘单质受热易升华,用加热法可以分离高锰酸钾和碘单质的混合物 | |
| B. | 分液时,分液漏斗内的上下层液体应分别都从下口放出 | |
| C. | 向溴水中加入苯,充分振荡后静置,上层无色,下层橙红色 | |
| D. | 配制100 g10%的CuSO4溶液,称取10 g硫酸铜固体溶于90 g水中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com