
.已知HCN(aq)与NaOH(aq)反应生成1 mol正盐的ΔH=-12.1 kJ/mol;强酸、强碱的稀溶液反应的中和热ΔH=-57.3 kJ·mol-1。则HCN在水溶液中电离的ΔH等于
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+69.4 kJ·mol-1 D.+45.2 kJ·mol-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
碲(Te)为ⅥA族元素,是当今高新技术新材料的主要成分之一。工业上可从电解精炼铜的阳极泥中提取碲。
(1)粗铜中含有Cu和少量Zn、Ag、Au、TeO2及其他化合物,电解精炼后,阳极泥中主要含有TeO2、少量金属单质及其他化合物。电解精炼粗铜时,阳极电极反应式为____________。
(2)TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。从上述阳极泥中提取碲的一种工艺流程如下:
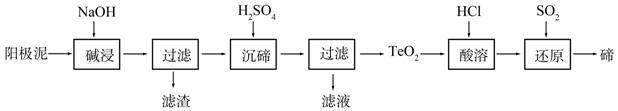
①“碱浸”时TeO2发生反应的化学方程式为_______________________________________。
②“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4过量,溶液酸度过大,将导致碲的沉淀
不完全,原因是____________________________________;防止局部酸度过大的操作方法是_______________________________________________________________。
③“酸溶”后,将SO2通入TeCl4溶液中进行“还原”得到碲,该反应的化学方程式是
______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
三氯异氰尿酸(结构简式如图)是养蚕业和水产养殖业最重要的消毒剂,三氯异氰尿酸水解生成X和NH4HCO3。下列关于X的说法不正确的是
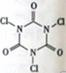
A.X的结构式为H—Cl—O B.X有强氧化性
C.X属于弱酸 D.X属于电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气中CO、NOx 以及燃煤废弃中的SO2都是大气污染物,对它们的治理具有重要意义。
Ⅰ.CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1= —574 kJ·mol- 1 .
CH4(g) + 4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H2= 一1160 kJ·mol- 1
(1)甲烷直接将NO2还原为N2的热化学方程式为 ;
Ⅱ.吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(2)装置Ⅱ中,酸性条件下,NO被Ce 4+ 氧化的产物主要是NO3- 、NO2- ,写出只生成NO3- 的离子方程式 ;
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
①生成的Ce4+ 从电解槽的 (填字母序号)口流出;
②生成S2O42 - 的电极反应式为 ;
(4)已知进入装置Ⅳ的溶液中,NO2- 的浓度为a g·L- 1 ,要
使1m3该溶液中的NO2- 完全转化为NH4NO3,至少需向装置Ⅳ
中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)


查看答案和解析>>
科目:高中化学 来源: 题型:
)磷酸燃料电池是目前较为成熟的燃料电池,其基本组成和反应原理如下。
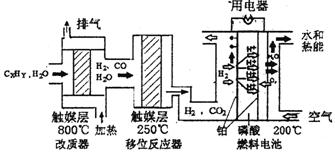
(1)在改质器中主要发生的反应为_______________________________
(2)移位反应器中CO(g)+H2O (g) 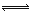 CO2 (g)+H2(g) ,在一定温度下,在1L容器中发生上述反应,各物质的物质的量浓度变化如下表:
CO2 (g)+H2(g) ,在一定温度下,在1L容器中发生上述反应,各物质的物质的量浓度变化如下表:
| t/min | COmol/L) | H2O(mol/L) | CO2(mol/L) | H2(mol/L) |
| 0 | 0.2 | 0.3 | 0 | 0 |
| 2 | n1 | n2 | n3 | 0.1 |
| 3 | n1 | n2 | n3 | 0.1 |
| 4 | 0.09 | 0.19 | 0.11 | 0.11 |
①此温度下,该反应的平衡常数为________
②反应在3~4 min之间,氢气的物质的量增多的原因可能是 (填代号)
A.充入水蒸汽 B.升高温度 C.使用催化剂 D.充入氢气
(3)磷酸燃料电池负极排出的气体主要是___ __,
该电池正极的电极反应为_ _ __。
(4)磷酸燃料电池的电极上镀了铂粉,这样做的目的,除了起到更好的导电作用外,还具备的作用是 。
(5)总体看来,整个体系中能量来自与CxHy与空气的反应,假设CxHy为辛烷,且
已知辛烷的燃烧热为5 518 kJ·mol-1,请写出辛烷燃烧热的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
一些烷烃的标准燃烧热如下表:
| 化合物 | 标准燃烧热(△H/kJ·mol-1) | 化合物 | 标准燃烧热(△H/kJ·mol-1) |
| 甲烷 | -891.0 | 正丁烷 | -2878.0 |
| 乙烷 | -1560.8 | 异丁烷 | -2869.6 |
| 丙烷 | -2221.5 | 异戊烷 | -3531.3 |
下列说法正确的是
A.热稳定性:正丁烷>异丁烷
B.正戊烷的标准燃烧热大约是△H=-3540kJ·mol-1
C.乙烷燃烧的热化学方程式为
2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) △H=-1560.8kJ·mol-1
D.在101kPa下,甲烷的热值是891.0kJ·g-1
查看答案和解析>>
科目:高中化学 来源: 题型:
“富勒烯”家族又增添了新成员,继C60、C70、N60之后,中美科学家首次发现了全硼富勒烯B40.下列说法正确的是
A. B40、C70都属于新型化合物 B. C60和N60属于同分异构体
C. B40、C60、C70、N60都属于烯烃 D. B40、C60、C70、N60都只含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
在化学学习、研究中,类推的思维方法有时会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中正确的是
A. CO2和Na2O2反应生成Na2CO3,推测:SO2和Na2O2反应生成Na2SO3
B.金属钠着火不能用CO2扑灭,推测:金属钾着火也不能用CO2扑灭
C. Fe3O4可表示为FeO·Fe2O3,推测:Pb3O4也可表示为PbO·Pb2O3
D. F、Cl、 Br,、I的单质熔点依次升高,推测:N、 P、As、 Sb、Bi单质熔点也依次升高
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,某溶液中由水电离的[H+]=1×10-13 mol·L-1,该溶液可能是( )
①三氧化硫水溶液 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液
A.①④ B.①② C.②③ D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com