
| A、用物质B表示反应的平均速率为0.3 mol?L-1?s-1 |
| B、2 s时气体密度与起始时气体密度之比为3:2 |
| C、2 s时物质A的转化率为70% |
| D、2 s时物质B的浓度为0.7 mol?L-1 |
| △c |
| △t |
| 消耗量 |
| 起始量 |
| n |
| V |
| ||
| 2s |
| 1.2mol |
| 4mol |
| 1.4mol |
| 2L |


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
| ||
| H+ |
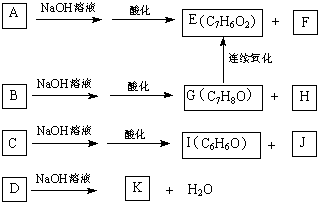
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、-260.4 kJ?mol-1 |
| B、-441.8 kJ?mol-1 |
| C、260.4 kJ?mol-1 |
| D、441.8 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
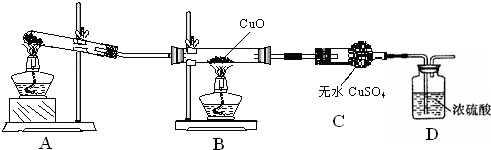
| A、H2还原CuO时,先加热盛CuO的试管后通入H2,以免浪费H2 |
| B、点易燃燃气体之前必修验纯 |
| C、稀释浓H2SO4时,将水注入盛浓H2SO4的烧杯 |
| D、给试管中液体加热时,为便于观察,试管口应对着自己 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com