
| A. | C4H10有三种同分异构体 | |
| B. | 乙醇、乙二醇、丙三醇互为同系物,同系物之间不可能为同分异物体 | |
| C. | 常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应 | |
| D. | 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 |
分析 A、根据碳链异构来解答;
B、结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物,同系物中官能团的种类与数目要相同;
C、根据反应自发进行的判断依据:△H-△S<0解答;
D、根据不同合金的材料和性能解答.
解答 解:A.C4H10有正丁烷、异丁烷两种同分异构体,故A错误;
B.乙醇、乙二醇与丙三醇所含羟基的个数不同,不为同系物,故B错误;
C.由方程式2S2O(g)═3S(s)+SO2(g)可知该反应△S<0,要使△H-△S<0,必须满足△H<0,故C正确;
D.不是所有的合金耐腐蚀都很差,例如钛合金、铝合金等具有很好的抗腐蚀性能,故D错误;
故选C.
点评 本题考查了金属的腐蚀与防护,同分异构体,同系物,反应方向判据,考查学生对基本知识的掌握程度,题目简单,属于基础题.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:选择题
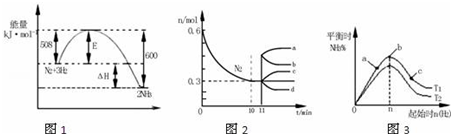
| A. | 由图1可知2NH3(g)?N2(g)+3H2(g)△H=-92kJ•mol-1 | |
| B. | 图2中0~10min内该反应的平均速率v(H2)=0.045mol•L-1•min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d | |
| C. | 图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 | |
| D. | 图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性 | B. | 最高价氧化物对应水化物的酸性 | ||
| C. | 单质与氢气反应的难易 | D. | 单质与氢气反应放出热量的多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
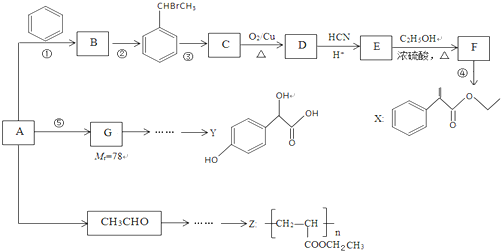
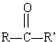 $→_{H+}^{HCN}$
$→_{H+}^{HCN}$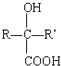 R或R′可以是烃基或氢原子
R或R′可以是烃基或氢原子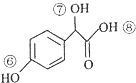 的说法正确的是AD.
的说法正确的是AD. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲、乙两烧杯中水电离出OH-浓度:甲<乙 | |
| B. | 分别稀释相同倍数,溶液pH变化:甲=乙 | |
| C. | 相同条件,AgCl(s)在甲中溶解度大于在乙中 | |
| D. | 向乙烧杯加入l0.0mL 0.1mol/L NaOH溶液后一定存在:c(H+)=c(CH3COO-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯食品袋耐高温加热 | |
| B. | 石英玻璃仪器耐酸碱腐蚀 | |
| C. | 羊毛织物可用强碱性洗涤剂清洗 | |
| D. | 把铅加入锡中制造焊锡的目的是降低熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠与水反应生成2.24 L O2时转移的电子数为0.2NA | |
| B. | 1 L 14 mol/L硝酸与足量铜反应生成气体分子数小于7NA | |
| C. | 1 L1 mol/L NaHS溶液中H2S、HS-和S2-粒子数之和为NA | |
| D. | 1 mol OH-的电子总数比1 mol-OH的电子总数多NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
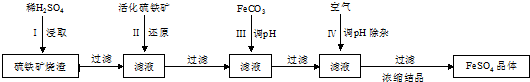
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
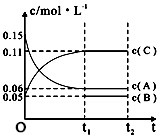
| A. | 若a=3,则b=1,c=2 | |
| B. | t1min时,该反应达到该条件下的反应限度 | |
| C. | 在O~t1min内,用C表示的化学反应速率为0.06mol•L-1 | |
| D. | B的起始浓度等于0.08mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com