
某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。

(1)比较两实验装置,图2所示装置的优点是:
①能更好地吸收有毒气体SO2,防止其污染环境;
②___________________________________________。
(2)能说明有SO2气体产生的实验现象是_________________________________________________。
(3)反应一段时间后,用滴管吸取A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空白:
A.稀盐酸溶液 B.稀硫酸溶液
C.KSCN溶液 D.KMnO4溶液
E.NaOH溶液 F.淀粉KI溶液
G.H2O2溶液
验证Ⅱ:取试样,先滴加少量的________(填试剂序号,下同),振荡,再滴加少量的________,根据溶液颜色的变化可确定假设Ⅱ是否正确。
验证Ⅲ:步骤1.取试样,滴加少量的________(填试剂序号),溶液的颜色变________色则试样中含有Fe3+,发生反应的离子方程式为_______________________________。
步骤2.再取适量的试样滴加到少量的________(填试剂序号),溶液的颜色变为________色,则试样中含有Fe2+。
【解析】 (1)比较两个装置的不同点,发现发生装置设计不同,可抽动的铁丝可以随时控制反应的发生与停止,而铁片却不具有这样的优势。(3)检验溶液中仅含Fe2+需事先确定溶液中是否含Fe3+(用KSCN溶液),再利用氧化剂(不要有很深的颜色,以免影响血红色的观察)把Fe2+氧化成Fe3+,观察有无血红色现象出现;检验溶液中既有Fe2+又有Fe3+,首先可用KSCN溶液检验Fe3+的存在,因为Fe3+的存在必然会影响Fe2+的检验,故只能选择KMnO4溶液与Fe2+反应,观察KMnO4溶液颜色的变化情况。
【答案】 (1)便于控制反应的发生和停止
(2)品红溶液褪色
(3)验证Ⅱ:C G
验证Ⅲ:步骤1:C(或F) 红(或蓝)
Fe3++3SCN-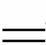 Fe(SCN)3(或2Fe3++2I-
Fe(SCN)3(或2Fe3++2I-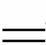 2Fe2++I2)
2Fe2++I2)
步骤2:D 浅红或变浅


科目:高中化学 来源: 题型:
D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简氢化物分子的空间构型依次是正四面体、三角锥形、正四面体、角形(V形)、直线形。回答下列问题:
(1)Y的最高价氧化物的化学式为 ;
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是 ,写出该元素的任意3种含氧酸的化学式: ;
(3)D和Y形成的化合物,其分子的空间构型为 ;
(4)D和X形成的化合物,其化学键类型属 ,其晶体类型属 ;
(5)金属镁和E的单质在高温下反应得到的产物是 ,此产物与水反应生成两种碱,该反应的化学方程式是 。
(6)试比较D和X的最高价氧化物熔点的高低并说明理由:
查看答案和解析>>
科目:高中化学 来源: 题型:
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
下列叙述正确的是
A.X、Y元素的金属性X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为____________________________________________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是________(写化学式),非金属气态氢化物还原性最强的是________(写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有________________________(写出其中两种物质的化学式)。
(4)ZX的电子式为________________;ZX与水反应放出气体的化学方程式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是
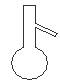

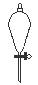
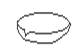
A.蒸馏、蒸发、分液、过滤 B.蒸馏、过滤、分液、蒸发
C.分液、过滤、蒸馏、蒸发 D.过滤、蒸发、分液、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质相互混合反应,既有气体生成,最终又有沉淀生成的是
①金属钠投入到FeCl3溶液 ②过量NaOH溶液和明矾溶液
③Ba(HCO3)2溶液和NaHSO4溶液 ④Na2O2投入FeCl3溶液
A.①④ B.②③④ C.②③ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A、16O、18O互为同位素
B、金刚石和石墨互为同素异形体
C、分子式符合通式CnH2n+2 且 n 值不同的两种烃互为同系物
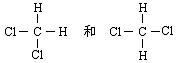
D、 互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5。

(1)装置Ⅰ中产生气体的化学方程式为______________________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是______。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。

实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO 的电离程度大于水解程度,可采用的实验方法是________(填序号)。
的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液
c.加入盐酸 d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检测Na2S2O5晶体在空气中已被氧化的实验方案是
________________________________________________________________________
________________________________________________________________________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com