
| A、用托盘天平称量5.85 g氯化钠固体 |
| B、从试剂瓶中取Na2CO3溶液,发现取量过多,为了不浪费,把过量的试剂倒入原试剂瓶中 |
| C、用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
| D、用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 |


科目:高中化学 来源: 题型:
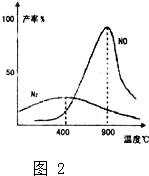
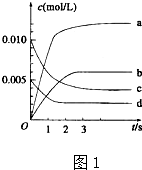 (1)在1L密闭容器内,800℃时发生反应:2NO(g)+O2(g)?2N02(g)△H<0,容器内各物质的浓度变化如图1所示.
(1)在1L密闭容器内,800℃时发生反应:2NO(g)+O2(g)?2N02(g)△H<0,容器内各物质的浓度变化如图1所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、判断皂化反应是否完全,可取反应后的混合液滴入热水中 |
| B、减压过滤不宜过滤胶状沉淀或颗粒太小的沉淀 |
| C、制备硫酸亚铁铵晶体,需加热至大量晶体析出并剩余少量液体即停止加热 |
| D、易燃试剂与强氧化性试剂需分开放置,并远离火源;金属着火时可用细沙覆盖灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:
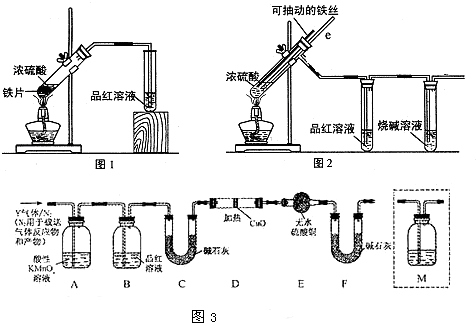
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱性溶液中:ClO-、Cl-、K+、Na+ |
| B、常温常压下气体:O2、N2、Cl2、NH3 |
| C、含有AlO2-的溶液:NO3-、HCO3-、Na+、K+ |
| D、氢氧化铁胶体:H+、K+、S2-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、NH4+、AlO2-、S2O32- |
| B、K+、Cu2+、OH-、Cr2O72- |
| C、Na+、Al3+、SO42-、NO3- |
| D、Ag+、Mg2+、CO32-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K(HF)=7.2×10-4 |
| B、K(HNO2)=4.9×10-10 |
| C、根据两个反应即可得出一元弱酸的强弱顺序为HF>HNO2>HCN |
| D、K(HCN)<K(HNO2)<K(HF) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com