
A.高浓度过氧乙酸不能直接使用
B.纯过氧乙酸是一种易爆物质
C.过氧乙酸具有强氧化性,没有酸性
D.过氧乙酸分子中含有极性键,也含有非极性键
 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
A.高浓度过氧乙酸不能直接使用
B.纯过氧乙酸是一种易爆物质
C.过氧乙酸具有强氧化性,没有酸性
D.过氧乙酸分子中含有极性键,也含有非极性键
查看答案和解析>>
科目:高中化学 来源:2014届江苏省盐城市高三上学期期中考试化学试卷(解析版) 题型:填空题
过氧乙酸是一种弱酸性氧化剂,广泛用作漂白剂和高效杀菌消毒剂等。
Ⅰ、制备:冰醋酸与H2O2浓溶液按体积比1:1混合,加入适量浓硫酸,控制温度5℃~30℃,搅拌30min并静置4~6h。
反应原理为:H2O2+CH3COOH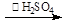
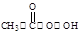 (过氧乙酸)+H2O
(过氧乙酸)+H2O
Ⅱ、含量测定:称取5.0000g过氧乙酸试样(液体),稀释至100mL备用。取上述稀释后过氧乙酸试样5.00mL,用0.0100 mol·L-1KMnO4溶液滴定到终点以除去其中的H2O2,随即加入10%KI溶液10mL,加入0.5%淀粉溶液3滴,摇匀,并用0.0500 mol·L-1Na2S2O3标准溶液滴定到蓝色刚好褪去(离子反应方程式为:I2+2S2O32-=2I-+S4O62-),消耗Na2S2O3标准溶液的总体积为20.00mL。
(1)制备过氧乙酸时,温度不宜过高,其原因可能是 。
(2)稀释样品时,除用到容量瓶及烧杯外,还用到的玻璃仪器有 、 。
(3)过氧乙酸溶液与KI反应的离子方程式为 。
(4)通过计算确定原试样中过氧乙酸的质量分数(写出计算过程)。 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(6分)过氧乙酸是一种广谱消毒剂,可用过氧化氢与乙酸反应制取,调节乙酸和过氧化氢的浓度可得到不同浓度的过氧乙酸。
过氧乙酸含量的分析方法如下:
准确称取0.5027 g过氧乙酸试样,置于预先盛有40 mLH20、5 mol 3 mol/LH2SO4溶液和2~3滴1 mol/L MnSO4溶液并已冷却至5℃的碘量瓶中,摇匀,用0.02366 mol/L KMnO4标准溶液滴定至溶液呈浅粉色(30 s不退色),消耗了12.49 mL;随即加人10 mL 20%KI溶液和2~3滴(NH4)2 MoO4溶液(起催化作用并减轻溶液的颜色),轻轻摇匀,加塞,在暗处放置5 min ~10 min,用0.1018 mol/LNa2S2O3标准溶液滴定,接近终点时加人3 mL 0.5%淀粉指示剂,继续滴定至蓝色消失,并保持30s不重新显色,为终点,消耗了Na2S2O3 23.61 mL。
1.写出与测定有关的化学方程式。
2.计算过氧乙酸的质量分数(要求3位有效数字;过氧乙酸的摩尔质量为76 .05g/mol)。
3.本法的KMnO4滴定不同于常规方法,为什么?
4.简述为什么此法实验结果只能达到3位有效数字。
5.过氧乙酸不稳定,易受热分解。写出热分解反应方程式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com