
(本题16分)无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业制备无水AlCl3的流程如下: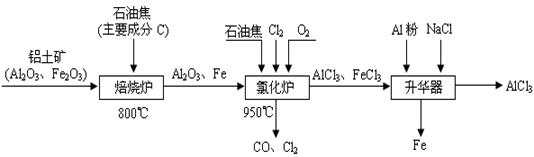
(1)氯化炉中通入O2的目的是 _________。
(2)氯化炉中Al2O3、C12和C反应的化学方程式是____________________________。
(3)氯化炉中导出的气体,通常用亚硫酸钠溶液来吸收,请写出用Na2SO3溶液处理尾气时发生反应的离子方程式___________________________________________________。
(4)在升华器中加入铝粉的目的是_________________________________________。
(5)用氯化铝晶体(AlCl3·6H2O)在HCl气中加热也能进行无水氯化铝的制备。但若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原氯化铝晶体(AlCl3·6H2O)的40%,则可推算n的值为 。
(6)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为___________________________________。
(1)与C反应,提供反应所需的热量 (2分)
(2)Al2O3+3Cl2+3C = 2AlCl3+3CO (800 ℃)(3分)
(3)SO32-+Cl2+H2O=SO42-+2H++2Cl- (3分)
(4)将FeCl3杂质还原成Fe除去 (2分)
(5)4 (3分)
(6)Al-3e-+4Cl-= AlCl4-(3分)
解析试题分析:工艺流程题要弄清原料及成分、所要制备的产品,给出的已知条件也是常设问题的地方要十分注意。
(1)通入氧气的目的,通氧气后出来的产物就可以知道是和碳反应,除此以外就是反应放热为其它反应提供能量。
(2)根据箭头的指向,C被还原成CO,氯气被还原成AlCl3,所以C+Al2O3+Cl2→CO+AlCl3
然后再利用氧化还原反应的配平方法进行配平。
(3)利用的是亚硫酸钠的还原性,氯气的氧化性,在溶液中亚硫酸根被氧化后生成硫酸根离子,氯气单质被还原后则是氯离子,写方程式时可以先写SO2+ Cl2→2Cl—+SO42—再根据电原子守恒和电荷守恒,在边补上水,右边补上氢离子,配平就可以了。
(4)由“升华器”处可知,要将铁元素除去,结合题意可知将FeCl3杂质还原成Fe除去。
(5)由2(AlCl3·6H2O)转化成Al2(OH)nCl(6-n)可知,
2×(27+35.5×3+6×18)×40%=27×2+17n+35.5×(6-n),求得n=4
(6)先写Al-3e- →AlCl4-,根椐原子守恒和电荷守恒补齐就行。
考点:氧化还原反应、离子反应方程式书写、电化学、与守恒法有关的计算。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
制造太阳能电池需要高纯度的硅,工业上制高纯硅常用以下反应:
①Si(s)+3HCl(g) 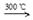 SiHCl3(g)+H2(g) +381 kJ
SiHCl3(g)+H2(g) +381 kJ
②SiHCl3(g)+H2(g) 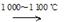 Si(s)+3HCl(g)
Si(s)+3HCl(g)
对上述两个反应的叙述中,错误的是
| A.两个反应都是置换反应 | B.反应②是吸热反应 |
| C.两个反应互为可逆反应 | D.两个反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
从海水中可以提取溴,主要反应为:2Br-+Cl2===2Cl-+Br2。下列说法正确的是( )
| A.溴离子具有氧化性 | B.氯气是还原剂 |
| C.该反应属于复分解反应 | D.氯气的氧化性比溴单质强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某稀硫酸和硝酸的混合溶液200 mL,分成两份。向其中一份逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO)。向另一份逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如下图所示。
(1)第二份溶液中最终溶质为 ;
(2)OA段产生的气体是 (填化学式),BC段产生的气体是 (填化学式),AB段的反应为 ;
(3)原混合酸中HNO3的物质的量为 mol,H2SO4的物质的量浓度应为 mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(13分)化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO 还原为N2。25℃时,反应进行10 min,溶液的pH由7变为12(常温下)。
还原为N2。25℃时,反应进行10 min,溶液的pH由7变为12(常温下)。
【 已知:pH=-lgc(H+),常温下,水溶液中c(H+)×c(OH-)=10-14 】
①N2的结构式为________。
②请补充离子方程式,并进行配平:上述反应离子方程式为(配平为1不省略)
( )NO +( )H2催化剂 ( )N2+( )H2O+( )__________,
+( )H2催化剂 ( )N2+( )H2O+( )__________,
其平均反应速率v(NO )= mol·L-1·min-1。
)= mol·L-1·min-1。
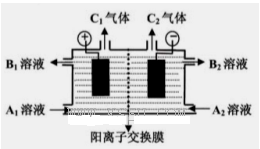
(2)电化学降解NO 的原理如图所示。
的原理如图所示。
①电源正极为________(填“A”或“B”),
阴极反应式为 。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)写出下列反应的化学方程式或离子方程式。
(1)漂白粉溶液中通入过量的二氧化碳的化学方程式 ___________________________
(2)足量的氯气通入到溴化亚铁溶液中的离子方程式_________________________________
(3)硫酸工业生产中在接触室中发生的反应的化学方程式_____________________________
(4)碳和浓硫酸反应的化学方程式__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)(2012?山东)偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(g) (Ⅰ)
(1)反应(Ⅰ)中氧化剂是 .
(2)火箭残骸中常现红棕色气体,原因为:N2O4(g)?2NO2(g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为 (填“吸热”或“放热”)反应.
(3)一定温度下,反应(Ⅱ)的焓变为△H.现将1mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是 .若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数 (填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)= mol/(L?s)﹣1.
(4)NO2可用氨水吸收生成NH4NO3.25℃时,将a mol NH4NO3溶于水,溶液显酸性,原因是 (用离子方程式表示).向该溶液滴加b L 氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将 (填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为 mol?L﹣1.(NH3?H2O的电离平衡常数取Kb=2×10﹣5 mol?L﹣1)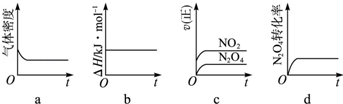
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法可回收WC和Co。工艺流程简图如下: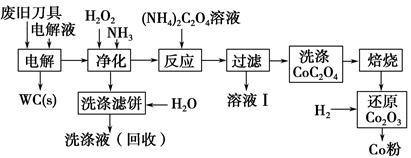
(1)电解时废旧刀具做阳极,不锈钢做阴极,HCl溶液为电解液。阴极主要的电极反应式为 。
(2)净化步骤所得滤饼的主要成分是 。回收的洗涤液代替水配制电解液,目的是回收利用其中的 。
(3)溶液Ⅰ的主要成分是 。洗涤CoC2O4不充分对最终产品纯度并无明显影响,但焙烧时会造成环境污染,原因是 。
(4)将Co2O3还原成Co粉的化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
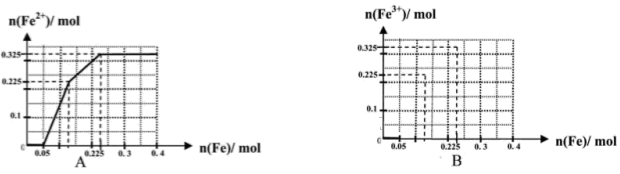
(一)(8分)在含有物质的量各为0.1 mol FeCl3、H2SO4、Cu(NO3)2的溶液500 mL中,逐渐加入铁粉,溶液中n(Fe2+)与加入n(Fe)的关系如图A(请注意识图,该题图中每小正方格长度为0.05mol)。(提示:忽略离子水解产生的影响;如果有硝酸根被还原时,则生成一氧化氮气体)
(1)写出图中n(Fe)从0.125mol-0.225 mol段对应反应的离子方程式____。
(2)写出图中n(Fe)从0-0.05 mol段对应反应的离子方程式____。
(3)请在图B中画出溶液中n(Fe3+)与加入n(Fe)的变化关系图
(4)当反应进行到最后,取该溶液2mL加入试管中,为了证明该溶液中有NO3-存在,可以向试管中在滴加_______。
| A.酸性KMnO4溶液 | B.含有盐酸的KSCN溶液 | C.碘水 | D.次氯酸钠溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com