

分析 硫铁矿烧渣用硫酸浸取,过滤后滤液中含有硫酸铁、未反应的硫酸,用活化硫铁矿还原Fe3+后过滤,向滤液中加入FeCO3调节溶液pH,过滤后在通入空气、调节溶液pH,除去溶液中杂质离子,过滤浓缩结晶得到FeSO4晶体.
(1)H2SO4与Fe2O3反应生成硫酸铁与水;
(2)用KSCN 溶液检验第Ⅱ步中Fe3+是否完全还原;
(3)氧气可以讲亚铁离子氧化为铁离子,铁离子水解使溶液pH降低;
(4)电池放电时的总反应为:4Li+FeS2═Fe+2Li2S,正极发生还原反应,FeS2获得电子生成Fe、S2-;
(5)发生反应:4FeCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+4CO2,根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,构造目标热化学方程式;
(6)第Ⅲ步应加入FeCO3后,浸取时加入的硫酸、活化硫铁矿还原Fe3+时生成的硫酸完全转化为FeSO4,根据FeS2~7Fe2(S04)3~7Fe2O3计算参加反应的FeS2的物质的量,根据硫元素守恒计算n总(FeSO4),由Fe元素守恒计算n(FeCO3),再根据m=nM计算其质量.
解答 解:硫铁矿烧渣用硫酸浸取,过滤后滤液中含有硫酸铁、未反应的硫酸,用活化硫铁矿还原Fe3+后过滤,向滤液中加入FeCO3调节溶液pH,过滤后在通入空气、调节溶液pH,除去溶液中杂质离子,过滤浓缩结晶得到FeSO4晶体.
(1)H2SO4与Fe2O3反应生成硫酸铁与水,反应离子方程式为:Fe2O3+6H+=2Fe3++3H2O,
故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)KMnO4溶液、K3[Fe(CN)6]溶液可以检验有Fe2+生成,取第Ⅱ步反应中溶液少许与试管中,滴加KSCN 溶液,若溶液不变红色,说明Fe3+完全被还原,
故答案为:C;
(3)氧气可以将Fe2+离子氧化为Fe3+离子,Fe3+离子水解生成H+,使溶液pH降低,
故答案为:氧气可以将Fe2+离子氧化为Fe3+离子,Fe3+离子水解生成H+;
(4)电池放电时的总反应为:4Li+FeS2═Fe+2Li2S,正极发生还原反应,FeS2获得电子生成Fe、S2-,正极电极反应式为:FeS2+4e-=Fe+2S2-,
故答案为:FeS2+4e-=Fe+2S2-;
(5)发生反应:4FeCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+4CO2,
已知:①4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol
②C(s)+O2(g)═CO2(g)△H=-393kJ/mol
③2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol
根据盖斯定律,①-③×2+②×④可得4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g),故△H=-1648kJ/mol-2×(-1480kJ/mol)+4×(-393kJ/mol)=-260kJ/mol,
故反应热化学方程式为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol,
故答案为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol;
(6)铁全部视为Fe2O3,其含量为p,akg烧渣中,Fe2O3质量为p×akg,铁的浸取率为q,侧参加反应的Fe2O3质量为pqcag,其物质的量为pqa×103g÷160g/mol=$\frac{25paq}{4}$mol,
bkg质量分数为c的硫酸中m(H2SO4)=bckg,其物质的量为(bc×103)g÷98g/mol=$\frac{1000bc}{98}$mol,
第Ⅲ步应加入FeCO3后,浸取时加入的硫酸、活化硫铁矿还原Fe3+时生成的硫酸完全转化为FeSO4,
根据电子得失守恒有关系FeS2~7Fe2(S04)3~7Fe2O3,可知参加反应的FeS2的物质的量$\frac{1}{7}$×$\frac{25paq}{4}$mol,
根据硫元素守恒计算n总(FeSO4)=$\frac{1}{7}$×$\frac{25paq}{4}$mol×2+$\frac{1000bc}{98}$mol,
由Fe元素守恒n(FeCO3)=n总(FeSO4)-n(FeS2)-2n(Fe2O3)=$\frac{1}{7}$×$\frac{25paq}{4}$mol×2+$\frac{1000bc}{98}$mol-$\frac{1}{7}$×$\frac{25paq}{4}$mol-2×$\frac{25paq}{4}$mol=$\frac{1000bc}{98}$mol-$\frac{325apq}{28}$mol,故m(FeCO3)=($\frac{1000bc}{98}$-$\frac{325apq}{28}$) mol×116g/mol=($\frac{58bc}{49}$-$\frac{377apq}{280}$)kg,
故答案为:$\frac{58bc}{49}$-$\frac{377apq}{280}$
点评 本题以化学工艺流程为载体,考查离子方程式书写、离子检验、热化学方程式书写、电极反应式、化学计算等,需要学生熟练掌握元素化合物知识,(6)中计算为易错点、难点,注意利用守恒法计算,避免计算繁琐,较好的考查学生分析计算能力.


 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 当Al3+恰好完全沉淀时,消耗氢氧化钡1.5mol | |
| B. | 当SO42-恰好完全沉淀时,Al3+全部转化为Al(OH)3 | |
| C. | 当向溶液中加入1.5mol氢氧化钡时,反应可用下列离子方程式表示:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| D. | 反应过程中随加入的氢氧化钡的物质的量不断增大,沉淀的质量不断增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
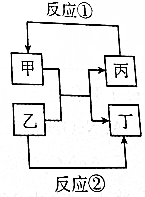 甲、乙、丙、丁四种取值的相互转化关系如图所示(部分反应物、产物及反应条件已略去).已知甲为常见金属(Na、Mg、Al、Fe、Cu)或其氧化物,回答下列问题:
甲、乙、丙、丁四种取值的相互转化关系如图所示(部分反应物、产物及反应条件已略去).已知甲为常见金属(Na、Mg、Al、Fe、Cu)或其氧化物,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol•L-1) | 0.44 | 0.6 | 0.6 |
| A. | 该反应的平衡常数表达式为:K=[c(CH3OCH3)×c(H2O)]/c(CH3OH) | |
| B. | 此时正、逆反应速率的大小:v正<v逆 | |
| C. | 若加入CH3OH后,经10 min达到平衡,此时c(CH3OH)=0.04 mol/L | |
| D. | 10 min达到平衡时,反应速率v(CH3OH)=1.6 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
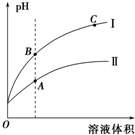
 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示.
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 牙膏 | 两面针儿童牙膏 | 珍珠王防臭牙膏 | 中华透明牙膏 |
| 摩擦剂 | 氢氧化铝 | 碳酸钙 | 二氧化硅 |
| 摩擦剂的物质类别(指酸、碱、盐、氧化物、两性氢氧化物) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:| 醋酸 | 碳酸 | 亚硫酸 |
| Ka=1.75×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
. +4NaOH$→_{△}^{H_{2}O}$
+4NaOH$→_{△}^{H_{2}O}$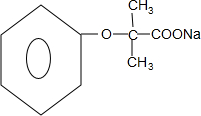 +3NaCl+2H2O.
+3NaCl+2H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
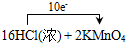 ═2KCl+2MnCl2+5Cl2↑+8H2O
═2KCl+2MnCl2+5Cl2↑+8H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com