
【题目】(1)0.5 mol CH4的质量是_____________,在标准状况下的体积为____________;含电子的物质的量是_____________。
(2)同温同压下,等质量的O2和CO2 ,物质的量之比为______________,原子个数比为_____________,密度比为_______________。
(3)下列数量的各物质所含原子数按由大到小的顺序排列是____________________。
①0.5 mol氨气 ②标准状况下22.4 L氦气
③4 ℃时9 mL水 ④0.2 mol磷酸钠(Na3PO4)
【答案】8g 11.2L 5mol 11:8 11:12 8:11 ①④③②
【解析】
(1)利用m=n×M,V=n×Vm进行计算;
(2)利用阿伏伽德罗定律及其推论进行分析,同温同压下,分子数之比等于物质的量之比,密度与摩尔质量成正比;
(3)利用以物质的量为核心的有关计算公式进行计算。
(1)m=n×M=0.5mol×16g/mol=8g;在标准状况下的体积为V=n×Vm=0.5mol×22.4L/mol=11.2L;含电子的物质的量是0.5mol×10=5mol;
(2)同温同压下,等质量的O2和CO2 ,物质的量之比为![]() :
:![]() =11:8;原子个数之比
=11:8;原子个数之比![]() =11:12,同温同压下密度与摩尔质量成正比,故密度之比是32:44=8:11;
=11:12,同温同压下密度与摩尔质量成正比,故密度之比是32:44=8:11;
(3)①0.5mol氨气中含原子为0.5mol×4=2.0mol;
②标准状况下22.4L氦气含原子为![]() =1.0mol;
=1.0mol;
③4℃时9mL水中含原子为![]() ×3=1.5mol;
×3=1.5mol;
④0.2mol磷酸钠(Na3PO4)中含原子为0.2mol×8=1.6mol;
则所含原子数按由大到小的顺序为①④③②。


科目:高中化学 来源: 题型:
【题目】实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:(己知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃
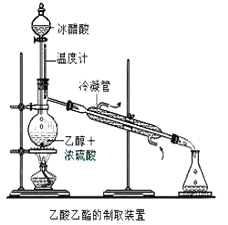
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是______________。
(2)在烧瓶中加入一定比例的乙醇和浓硫酸的混合液的方法是:_______________。
(3)在该实验中,若用lmol乙醇和lmol乙酸在浓硫酸作用下加热,充分反应,能否生成lmol乙酸乙酯?原因是___________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。

试剂a是__________,试剂b是_______________;分离方法①是________,分离方法②是__________,分离方法③是________________。
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是____________________。
(6)写出C→D反应的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是应用广泛的燃料,但含有少量H2S等气体。在酸性溶液中利用硫杆菌可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是( )
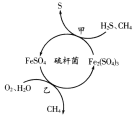
A.过程甲中发生反应的离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+
B.脱硫过程O2间接氧化H2S
C.该脱硫过程需要不断添加Fe2(SO4)3溶液
D.过程乙发生反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.臭氧的摩尔质量是48 g
B.同温同压条件下,等质量的氧气和臭氧体积比为2∶3
C.16 g臭氧中含有6.02×1023个原子
D.1.00 mol臭氧中含有电子总数为18×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.1 mol N2与4 mol H2混合充分反应,则反应中转移的电子数目为6 mol
B.反应2Mg(s)+CO2(g)= C(s)+2MgO(s) 能自发进行,则该反应的ΔH>0
C.向0.1 mol·L1 CH3COONa溶液中加入少量水,溶液中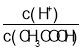 减小
减小
D.在稀溶液中:H+(aq)+OH-(aq)= H2O(l) ΔH= -57.3kJ·mol1,若将含0.5 mol H2SO4的浓硫酸与1 L 1.0 mol·L1 的NaOH溶液混合,放出的热量大于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某石油化工产品X的转化关系如图,下列判断不正确的是( )
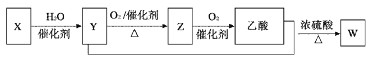
A. X可以发生加聚反应B. Y能与钠反应产生氢气
C. Z与CH3OCH3互为同分异构体D. W的结构简式为CH3COOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。下面是工业水合肼法制备叠氮化钠的工艺流程:

查阅资料:
①水合肼(N2H4·H2O)有毒且不稳定,具有强还原性和强碱性。
②有关物质的物理性质如下表:
物质 | 熔点℃ | 沸点℃ | 溶解性 |
CH3OH | -97 | 64.7 | 与水互溶 |
水合肼(N2H4·H2O) | -40 | 118.5 | 与水、醇互溶,不溶于乙醚 |
亚硝酸甲酯(CH3ONO) | -17 | -12 | 溶于乙醇、乙醚 |
叠氮化钠(NaN3) | 275 (410易分解) | —— | 易溶于水,微溶于醇, 不溶于乙醚 |
(1)合成水合肼。
实验室合成水合肼装置如图所示。NaClO碱性溶液与尿素CO(NH2)2水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
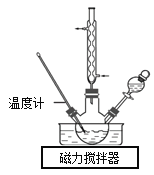
①制取N2H4·H2O的离子方程式为_________。
②实验中通过分液漏斗滴加的溶液是_________,理由是_________。
(2)水合肼法制备叠氮化钠。
①实验室模拟工艺流程步骤Ⅰ制备叠氮化钠的反应原理为:N2H4·H2O(aq)+CH3ONO(g)+NaOH(aq)=NaN3(aq)+CH3OH(aq)+3H2O(l) △H﹤0, 研究表明该反应在20℃左右反应的选择性和转化率最高,实验时可以采取的措施是_________。
②步骤Ⅱ回收CH3OH的实验操作名称为________。
③请设计由B溶液获得叠氮化钠(NaN3)产品的实验方案:_________[实验中可供选择的试剂有:乙醇、乙醚;除常用仪器外须使用的仪器有:布氏漏斗、真空干燥箱]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
A. 图甲表示可逆反应A(g)+2B(g)2C(g),速率随外界条件的改变曲
B. 图乙表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
C. 图丙表示用0.1mol/L NaOH溶液滴定20.00mL 0.1mol/LCH3COOH溶液得到的滴定曲线
D. 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)N2O4(g)相同时间后测得NO2含量的曲线,则该反应的△H<0 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com