
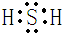 ,其相对分子质量与H2O2的相对分子质量相等,但其沸点却低于H2O2的沸点,可能的原因是:H2O2分子间可以形成氢键,从而导致其沸点升高,故答案为:
,其相对分子质量与H2O2的相对分子质量相等,但其沸点却低于H2O2的沸点,可能的原因是:H2O2分子间可以形成氢键,从而导致其沸点升高,故答案为: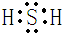 ;H2O2分子间可以形成氢键,从而导致其沸点升高;
;H2O2分子间可以形成氢键,从而导致其沸点升高;

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:
| A、③ | B、④ | C、③④ | D、①② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH |
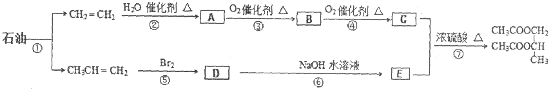
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
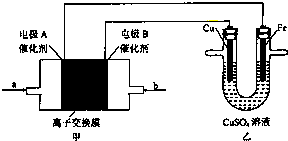
| A、工作是,Cu电极的电极反应为Cu2++2e-=Cu |
| B、工作一段时间后,Cu电极的质量将减小,Fe电极的质量将增加 |
| C、若甲池中a是CH4,b是O2,电解质溶液是KOH,则甲池内溶液的pH将升高 |
| D、若甲池电解质溶液为稀H2SO4,则a为O2,电极A反应为O2+4H++4e-=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com