
| A、Na+、Cu2+、Cl-、SO42- |
| B、Na+、Ca2+、CO32-、NO3- |
| C、Na+、H+、Cl-、CO32- |
| D、K+、H+、SO42-、OH- |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、含有大量Fe3+的溶液:Na+、SCN-、OH-、NO3- |
| B、碱性溶液:K+、Ca2+、Cl-、CO32- |
| C、酸性溶液:Na+、NH4+、SO42-、Cl- |
| D、含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na在足量O2中燃烧,消耗l mol O2时转移的电子数是4×6.02×1023 |
| B、盐酸和醋酸的混合溶液pH=1,该溶液中c(H+)=0.1 mol/L |
| C、1 L 0.1 mol/L NH4Cl溶液中的NH4+数是0.1×6.02×1023 |
| D、标准状况下2.24 L Cl2中含有0.2 mol 共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2 |
| B、CO2 |
| C、NH3 |
| D、SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+、Mg2+、SO42-、Cl- |
| B、Ca2+、I-、Na+、NO3- |
| C、Al3+、Cu2+、SO42-、Cl- |
| D、K+、Cl-、HCO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
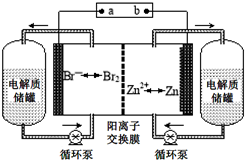 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )| A、阳离子交换膜可阻止Br2与Zn直接发生反应 |
| B、放电时负极的电极反应式为Zn-2e-=Zn2+ |
| C、充电时电极a连接电源的负极 |
| D、放电时左侧电解质储罐中的离子总浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在Na2O2与水反应实验中,发现Na2O2与水反应后的溶液中滴加酚酞试液溶液呈现红色,但红色很快褪色,甲、乙、丙三同学对此分别做了如下推测.
在Na2O2与水反应实验中,发现Na2O2与水反应后的溶液中滴加酚酞试液溶液呈现红色,但红色很快褪色,甲、乙、丙三同学对此分别做了如下推测.查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T是地壳中含量最多的金属元素,下列判断的正确是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T是地壳中含量最多的金属元素,下列判断的正确是( )| A、最简单气态氢化物的热稳定性:Q>R |
| B、最高价氧化物对应水化物的酸性:Q<W |
| C、原子半径:T>Q>R |
| D、含T元素的盐溶液一定显酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com