
| A. | CO32- | B. | OH- | C. | SO42- | D. | HCO3- |
分析 向某溶液中加入BaCl2溶液,再加入稀HNO3至溶液呈酸性,有白色沉淀产生,生成的白色沉淀是不溶于稀硝酸的硫酸钡沉淀或氯化银沉淀,原溶液中可能含有的阴离子为硫酸根离子或者亚硫酸根离子,以此解答该题.
解答 解:A.若是碳酸根离子,生成的碳酸钡溶于硝酸,不能判断是否含有碳酸根离子,故A错误;
B.氢氧根离子不能与氯化钡生成沉淀,无法判断是否含有氢氧根离子,故B错误;
C.溶液中含有硫酸根离子,加入氯化钡生成了不溶于稀硝酸的硫酸钡沉淀,故C正确;
D.碳酸氢根离子不能与氯化钡生成沉淀,无法判断是否含有碳酸氢根离子,故D错误;
故选C.
点评 本题考查了硫酸根离子的检验,为高频考点,侧重于学生的分析能力,记住常见的离子检验方法,本题注重了基础知识的考查,本题难度不大.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | 实验室用NH4Cl与NaNO2溶液混合微热制N2 | |
| B. | SnCl4与水的反应:SnCl4+2H2O═SnO2+4HCl | |
| C. | 人工树叶制取甲烷:CO2+2H2O$\frac{\underline{\;\;\;\;\;\;\;光\;\;\;\;\;\;\;}}{人工树叶}$CH4+2O2 | |
| D. | 银针验毒:4Ag+2H2S+O2═2Ag2S+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
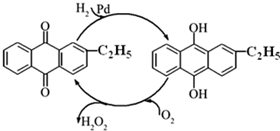 过氧化氢是重要的氧化剂和还原剂,常周于消毒、杀菌、漂白等.某化学兴趣小组同学.围绕着过氧化氢开展了调査研究与实验.
过氧化氢是重要的氧化剂和还原剂,常周于消毒、杀菌、漂白等.某化学兴趣小组同学.围绕着过氧化氢开展了调査研究与实验.| 实验编号 | T/X | H2O2初始浓度/moL•L-1 | FeCl3初始浓度/moL•L-1 |
| I | 20 | 1.0 | 0 |
| n | 50 | 1.0 | 0 |
| in | 50 | 1.0 | 0.1 |
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| n(M):n(H2O) | M转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.33 |
| 1:3 | 0.75 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com