
分析 T、X、Y、Z为短周期主族元素,T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,则T为Na;X的原子最外层电子数是其内层电子数的三倍,X已知只能有2个电子层,最外层电子数为6,则X为O元素;Y在第三周期元素中,Y的简单离子半径最小,则Y为Al;Na、O、Z组成的36电子的化合物A是家用消毒剂的主要成分,则Z为Cl、A为NaClO,据此进行解答.
解答 解:短周期主族元素,T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,T为Na;X的原子最外层电子数是其内层电子数的三倍,X原子只能有2个电子层,最外层电子数为6,则X为O元素;在第三周期元素中,Y的简单离子半径最小,则Y为Al;T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分,可推知Z为Cl,A为NaClO,
(1)Z为Cl元素,处于元素周期表中第三周期ⅦA族,
故答案为:三;ⅦA;
(2)元素Na与O按原子个数比1:1形成的化合物B为Na2O2,过氧化钠中含有的化学键为离子键和共价键,
故答案为:离子键、共价键;
(3)T的最高价氧化物对应水化物为NaOH,Y与Z形成的化合物为AlCl3,将氢氧化钠逐滴加入氯化铝溶液中先反应生成氢氧化铝沉淀,离子反应方程式为:Al3++3OH-═Al(OH)3↓,氢氧化钠过量,继续与氢氧化铝反应生成偏铝酸钠,此过程中的现象是:开始产生白色沉淀,然后白色沉淀消失,
故答案为:开始产生白色沉淀,然后白色沉淀消失;
(4)1mol NaClO与足量Na2SO3在溶液中发生反应时,转移2mol电子,亚硫酸根被氧化为硫酸根,令Cl元素在还原产物中的化合价为a,根据电子转移守恒,1mol×(1-a)=2mol,解得a=-1,故还原产物为氯离子,该反应的离子方程式为:SO32-+ClO-═SO42-+Cl-,
故答案为:SO32-+ClO-═SO42-+Cl-.
点评 本题考查结构性质位置关系应用,明确元素种类是关键,题目难度适中,涉及化学反应方程式书写、离子反应方程式书写等,侧重对基础知识的巩固,注意对基础知识的理解掌握.


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:选择题
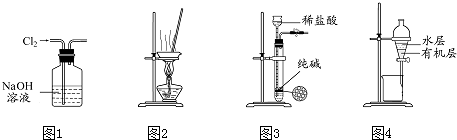
| A. | 用图1 所示装置除去Cl2中含有的少量HCl | |
| B. | 用图2 所示装置蒸干NH4HCO3饱和溶液制备NH4HCO3晶体 | |
| C. | 用图3 所示装置制取少量纯净的CO2气体 | |
| D. | 用图4 所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | Y |
| Z |
| A. | Z、X、Y形成的气态氢化物稳定性依次增强 | |
| B. | 四种元素形成的单质最多有6种 | |
| C. | 四种元素的原子半径:rZ>rY>rX>rW | |
| D. | 四种元素中,X的氧化物对应的水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增多 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 催化剂能增大单位体积内分子的总数,从而成千上万倍地增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8 g乙烯与丙烯的混合物中含碳原子的数目为0.2NA | |
| B. | 等物质的量的氢氧根离子(OH-)与羟基(-OH)所含电子数相等 | |
| C. | 常温常压下28 g CO与22.4 L O2所含分子数相等 | |
| D. | 16 g CH4与18 g NH4+所含质子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
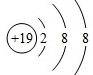 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
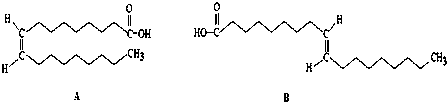
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l);△H1 2H2(g)+O2(g)═2H2O(g);△H2 | |
| B. | S(g)+O2(g)═2SO2(g);△H1 S(s)+O2(g)═2SO2(g);△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com