分析:有A、B、C、D、E、F六种元素,A是宇宙中最丰富的元素,A为氢元素;B是周期表中电负性数值最大的元素,B为氟元素;C的基态原子中2p轨道有三个未成对的单电子,外围电子排布为2s
22p
3,故C为氮元素;F原子核外电子数是B与C核外电子数之和,核外电子数为9+7=16,故F为硫元素;E能分别形成红色(或砖红色)的E
2O和黑色的EO两种氧化物,E为Cu元素,D与B可形成离子化合物,由晶胞结构图1可知,晶胞中D位于顶点与面心上,故晶胞中含有D元素数目为8×
+6×
=4,F原子处于晶胞内部,晶胞含有氟原子数目为8,故为DF
2,D为+2价,D是主族元素,且与副族元素E同周期,故D为Ca元素,据此解答.
解答:解:有A、B、C、D、E、F六种元素,A是宇宙中最丰富的元素,A为氢元素;B是周期表中电负性数值最大的元素,B为氟元素;C的基态原子中2p轨道有三个未成对的单电子,外围电子排布为2s
22p
3,故C为氮元素;F原子核外电子数是B与C核外电子数之和,核外电子数为9+7=16,故F为硫元素;E能分别形成红色(或砖红色)的E
2O和黑色的EO两种氧化物,E为Cu元素,D与B可形成离子化合物,由晶胞结构图1可知,晶胞中D位于顶点与面心上,故晶胞中含有D元素数目为8×
+6×
=4,F原子处于晶胞内部,晶胞含有氟原子数目为8,故为DF
2,D为+2价,D是主族元素,且与副族元素E同周期,故D为Ca元素,
(1)E是Cu元素,是29号元素,原子基态时的外围电子排布式为3d
104s
1,故答案为:3d
104s
1;
(2)A
2F分子是H
2S,S原子成2个S-H键,含有2对孤对电子对,杂化轨道数目为4,采取sp
3杂化,SO
3分子中价层电子对=3+
(6-3×2)=3,该分子中不含孤电子对,所以是平面三角形结构,其键角是60°,故答案为:sp
3;60°;
(3)NH
3中N元素的电负性很强,与水分子之间形成氢键,且二者都是极性分子,故氨气极易溶于水,
NH
3?H
2O分子中NH
3与H
2O通过氢键连接,氨水溶液呈碱性,如果氢键为
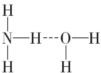
,N-H键断裂产生NH
2-、H
3+O,溶液呈酸性;
如果氢键为
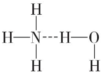
,O-H断裂产生NH
4+、OH
-,溶液呈碱性,故为

,b正确,
故答案为:与水分子之间形成氢键,且二者都是极性分子;b;
(4)由晶胞结构图1可知,晶胞中D位于顶点与面心上,故晶胞中含有D元素数目为8×
+6×
=4,F原子处于晶胞内部,晶胞含有氟原子数目为8,故为CaF
2,电子式为

,晶胞的质量为
,晶体的密度为ρ(g?cm
-3),则晶胞的体积是
,
故答案为:

;
;
(5)BF
3和过量NaF作用可生成NaBF
4,BF
4-中B原子的价层电子对=4+
(3+1-4×1)=4,该离子中不含孤电子对,为正四面体结构,故答案为:正四面体;
(6)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为共价键,层间作用力为范德华力,故答案为:共价键;范德华力.




 ,N-H键断裂产生NH2-、H3+O,溶液呈酸性;
,N-H键断裂产生NH2-、H3+O,溶液呈酸性; ,O-H断裂产生NH4+、OH-,溶液呈碱性,故为
,O-H断裂产生NH4+、OH-,溶液呈碱性,故为 ,b正确,
,b正确, ,晶胞的质量为
,晶胞的质量为 ;
;












