
【题目】某同学为验证盐酸、碳酸和硅酸的酸性强弱,用如图装置进行实验: 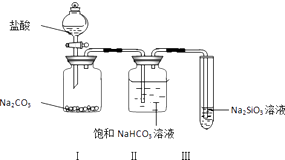
回答下列问题.
(1)装置Ⅰ中的现象是装置Ⅱ的作用是 , 其中可能发生反应的离子方程式是 .
(2)装置Ⅲ中的现象是 , 反应的化学方程式是 .
(3)该实验的实验结论是 .
【答案】
(1)固体溶解并有气泡产生;吸收CO2中混有的HCl气体;H++HCO3﹣=CO2↑+H2O
(2)有白色沉淀产生或有胶状物产生;CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3
(3)酸性:盐酸>碳酸>硅酸
【解析】解:(1.)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,所以I中可能的现象是固体溶解且有气泡生成;盐酸具有挥发性,且碳酸钠和稀盐酸反应为放热反应,生成的二氧化碳中含有HCl,饱和碳酸氢钠能和HCl反应但和二氧化碳不反应,所以II的目的是吸收二氧化碳中混有的HCl,离子方程式为H++HCO3﹣=CO2↑+H2O;所以答案是:固体溶解并有气泡产生;吸收CO2中混有的HCl气体;H++HCO3﹣=CO2↑+H2O;
(2.)碳酸酸性大于硅酸,二氧化碳通入硅酸钠溶液中有难溶性的硅酸生成,所以看到的现象是有白色沉淀产生或有胶状物产生,反应方程式为CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3 , 所以答案是:有白色沉淀产生或有胶状物产生;CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3;
(3.)强酸能和弱酸盐反应生成弱酸,通过以上分析知,盐酸能制取碳酸、碳酸能制取硅酸,所以酸性:盐酸>碳酸>硅酸,所以答案是:酸性:盐酸>碳酸>硅酸.


科目:高中化学 来源: 题型:
【题目】下列关于稀有气体的叙述不正确的是
A.各能级电子排布为“全充满”状态
B.其原子与同周期ⅠA、ⅡA族元素的阳离子具有相同的核外电子排布
C.化学性质非常不活泼
D.同周期中第一电离能最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究
实验操作Ⅰ:在试管中加入5mL 1mol/L NaOH溶液和5mL溴乙烷,振荡.
实验操作Ⅱ:将试管如图固定后,水浴加热.
(1)用水浴加热而不直接用酒精灯加热的原因是___________________________________;
(2)鉴定生成物中乙醇的结构,可用的波谱是__________________,__________________;
(3)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是__________________,检验的方法是______________________________________(需说明所用的试剂、简单的实验操作及预测产生的实验现象).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如右图。下列叙述正确的是( )
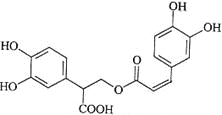
A. 迷迭香酸属于芳香烃
B. 1mol迷迭香酸最多能和9mol氢气发生加成反应
C. 迷迭香酸可以发生水解反应、取代反应和酯化反应
D. 1mol迷迭香酸最多能和含5mol NaOH的水溶液完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据海水综合利用的工业流程图(如图),判断下列说法正确的是:
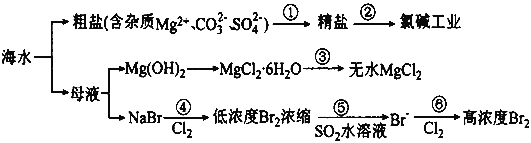
A.过程①的提纯只有物理过程,过程②通过氧化还原反应可产生两种单质
B.在过程③中将MgCl2·6H2O真接灼烧即可制得纯净无水MgCl2
C.过程⑥所得的高浓度溴水只需分液即可获得液溴
D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素基态原子M层上有一个未成对的单电子,则该基态原子价电子排布不可能是( )
A.3d14s2B.3d94s2C.3s23p1D.3s23p5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—物质结构与性质】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F原子基态的外围核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是 (用元素符号回答)。
(3)元素B的简单气态氢化物的沸点 (高于,低于)元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。
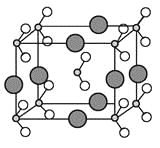
(7)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 , 仍存在的缺陷是 . 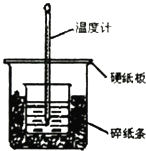
(2)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为△H1 , 则△H1与△H的关系为:△H1△H(填“<”、“>”或“=”).
(3)写出该反应的中和热的热化学方程式(中和热为57.3kJ/mol): .
(4)取50mL NaOH溶液和30mL硫酸溶液进行实验,装置已做改进.实验数据如表.
起始温度/℃ | 终止温度/℃ | 温度差/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.35 | 27.6 | 3.25 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
又已知0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都近似为1g/cm3 , 中和后生成溶液的比热容c=4.18J/(g℃).则中和热△H=(取小数点后一位).
(5)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) .
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把H2SO4溶液倒入盛有NaOH溶液的小烧杯中
d.用温度计测定NaOH溶液起始温度后未清洗直接测定H2SO4溶液的温度
e.实验当天气温较高.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com