
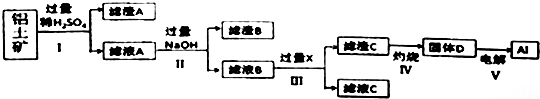
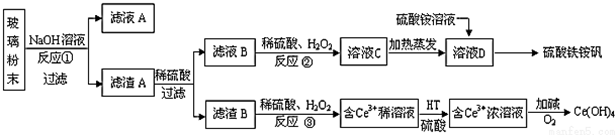
分析 SiO2和稀硫酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能反应,向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀.
铝土矿中加入稀硫酸,沉淀A为SiO2,滤液A中含有硫酸铝、硫酸铁,加入过量NaOH,沉淀B为Fe(OH)3,滤液B中含有NaAlO2,通入二氧化碳气体,滤液C中含有碳酸钠或碳酸氢钠,滤渣C为Al(OH)3,Al(OH)3在加热分解可生成D为Al2O3,电解Al2O3生成铝,以此解答该题.
解答 解:铝土矿中加入稀硫酸,沉淀A为SiO2,滤液A中含有硫酸铝、硫酸铁,加入过量NaOH,沉淀B为Fe(OH)3,滤液B中含有NaAlO2,通入二氧化碳气体,滤液C中含有碳酸钠或碳酸氢钠,滤渣C为Al(OH)3,Al(OH)3在加热分解可生成D为Al2O3,电解Al2O3生成铝,
(1)SiO2和稀硫酸不反应,则滤渣A是SiO2(或二氧化硅),滤液A中含有硫酸铝、硫酸铁,加入过量NaOH,沉淀B为Fe(OH)3,
故答案为:SiO2(或二氧化硅);Fe(OH)3(或氢氧化铁);
(2)过程 I、II、III分离溶液和沉淀,应为过滤操作,故答案为:过滤;
(3)过程 IV用于灼烧固体氢氧化铝,应在坩埚中进行,发生反应为2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
故答案为:坩埚;2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O;
(4)滤液B的成分是偏铝酸钠,向其中通入过量的二氧化碳,反应为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(5)根据以上分析滤液B中含有硫酸钠、偏铝酸钠、过量的氢氧化钠,向滤液中加入1mol/L盐酸200mL,沉淀量达到最大且质量为11.7g为Al(OH)3的质量,则根据铝原子守恒,c(AlO2-)=$\frac{n(AlOH)_{3}}{V}$=$\frac{\frac{11.7g}{78g/mol}}{0.1L}$=1.5mol•L-1,
最后所得的溶液中溶质为硫酸钠、氯化钠,根据钠离子守恒有n(NaOH)=n(NaCl)+2(Na2SO4),根据氯离子与硫酸根守恒有n(NaCl)=n(HCl)=0.2L×1mol/L=0.2mol,n(Na2SO4)=n(H2SO4)>$\frac{3}{2}$n(Al2(SO4)3)=$\frac{3}{2}$×$\frac{11.7}{78}$mol=0.225mol,故n(NaOH)=n(NaCl)+2(Na2SO4)>0.2mol+2×0.225mol=0.65mol,故c(Na+)>$\frac{0.65mol}{0.1L}$=6.5mol/L,
故答案为:1.5mol•L-1;6.5.
点评 本题以框图题形式考查铝的化合物的性质,为高频考点,侧重于学生的分析能力和实验能力的考查,难度中等,清楚冶炼铝工艺流程原理,是对知识迁移的综合运用.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量 | B. | 密度 | C. | 原子数 | D. | 物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
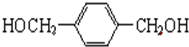 .
.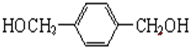 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$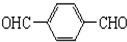 +2H2O.
+2H2O. .(原子量:Ag--108)
.(原子量:Ag--108)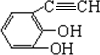 (只写出一种即可).
(只写出一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
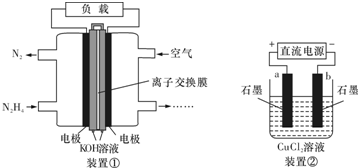
| A. | 该燃料电池负极发生的电极反应为:N2H4+4OH--4e-═N2+4H2O | |
| B. | 用该燃料电池作为装置②的直流电源,产生1molCl2至少需要通入0.5molN2H4 | |
| C. | 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 | |
| D. | 该燃料电池中,电子从右侧电极经过外电路流向左侧电极,溶液中OH-则迁移到左侧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com