
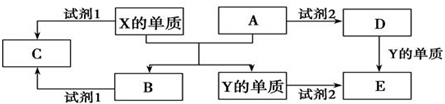
分析 X、Y是生活中常见的金属,分别为Al、Fe中的一种,A、B都是氧化物且A是红棕色粉末,X与氧化物A反应得到Y与氧化物B,则X为Al,Y为Fe,B为Al2O3,A为Fe的氧化物,若试剂1和试剂2均是强电解质,A与试剂2反应得到D,D与Fe反应得到E,而Fe与试剂2反应也得到E,则A为Fe2O3,试剂2为非氧化性酸,D为铁盐,E为亚铁盐,当试剂1和试剂2的酸碱性相同,Al与氧化铝与试剂1反应均得到C,则C为铝盐.若试剂1和试剂2的酸碱性不同,则试剂1为碱,C为偏铝酸盐,据此解答.
解答 解:X、Y是生活中常见的金属,分别为Al、Fe中的一种,A、B都是氧化物且A是红棕色粉末,X与氧化物A反应得到Y与氧化物B,则X为Al,Y为Fe,B为Al2O3,A为Fe的氧化物,若试剂1和试剂2均是强电解质,A与试剂2反应得到D,D与Fe反应得到E,而Fe与试剂2反应也得到E,则A为Fe2O3,试剂2为非氧化性酸,D为铁盐,E为亚铁盐,当试剂1和试剂2的酸碱性相同,Al与氧化铝与试剂1反应均得到C,则C为铝盐.若试剂1和试剂2的酸碱性不同,则试剂1为碱,C为偏铝酸盐.
(1)单质X与A反应的化学方程式是:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(2)若试剂1和试剂2均是强电解质.
①若试剂1和试剂2的酸碱性相同,则C为铝盐,溶液中铝离子水解,溶液显酸性,
故答案为:酸性;
②若试剂1和试剂2的酸碱性不同,试剂1为强碱,试剂1和氧化铝的离子方程式是:Al2O3+2OH-=AlO2-+H2O,
故答案为:Al2O3+2OH-=AlO2-+H2O;
(3)若试剂2是稀硝酸.
①Fe单质与稀硝酸反应生成亚铁盐时,Fe单质必须过量,该反应的离子方程式:3 Fe+8H++2NO3-═3 Fe2++3NO↑+4H2O,如果稀硝酸过量,会有铁离子生成,可以选择KSCN溶液进行验证,
故答案为:3 Fe+8H++2NO3-═3 Fe2++3NO↑+4H2O;KSCN溶液;
②D为铁盐,铁离子能够与强碱、氯气反应,生成一种高效的净水剂FeO42-,有关反应的离子方程式:Fe2++2OH-+Cl2=FeO42-+Cl-+H2O,
故答案为:Fe2++2OH-+Cl2=FeO42-+Cl-+H2O.
点评 本题考查无机物的推断,涉及Fe、Al元素单质化合物的性质,注意对铝热反应的掌握,在推断中经常涉及,熟练掌握元素化合物性质与转化,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 配制100mL2mol/LNaCl溶液,将称量的NaCl放入烧杯中加20-30mL的蒸馏水搅拌溶解 | |
| B. | 蒸馏操作时,应将温度计插入烧瓶中的溶液中 | |
| C. | 测溶液的pH时,将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较 | |
| D. | 分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
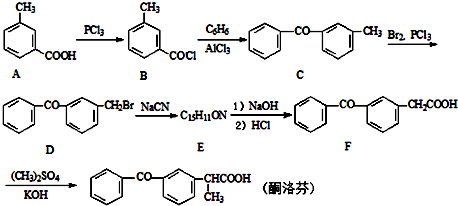
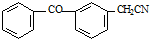 ;由C→D的反应类型是取代反应.
;由C→D的反应类型是取代反应.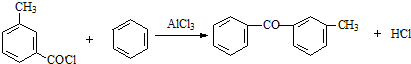 .
. .
.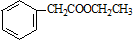 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$\stackrel{NaOH溶液}{→}$CH3CH2OH
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$\stackrel{NaOH溶液}{→}$CH3CH2OH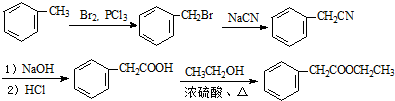 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打是面包发酵粉的主要成分之一 | |
| B. | 碳酸钠可作胃酸的中和剂 | |
| C. | “血液透析”利用了胶体的性质 | |
| D. | 利用明矾溶液的酸性清除铜镜表面的铜锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原溶液中一定含有SO42- | B. | 原溶液中一定含有NH4+ | ||
| C. | 原溶液中一定含有Cl- | D. | 原溶液中一定含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
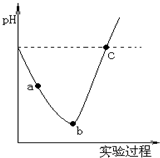 在常温下,取一定量的蒸馏水,然后将Cl2缓慢通入水中至饱和,再向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
在常温下,取一定量的蒸馏水,然后将Cl2缓慢通入水中至饱和,再向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验进程中可用pH试纸测定溶液的pH | |
| B. | 向a点所示溶液中能入SO2,溶液的酸性和漂白性均增强 | |
| C. | 由a点到b点的过程中,溶液中c(H+)/c(ClO-)减小 | |
| D. | c点所示的溶液中,c(Na+)=c(ClO-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
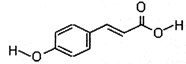
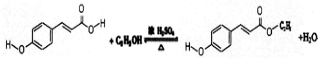 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
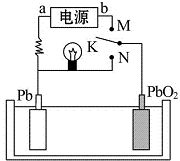
| A. | K与N相接时,Pb电极的反应式为Pb-2e-→Pb2+ | |
| B. | K与N相接时,SO42-向PbO2电极迁移 | |
| C. | K与M连接时,所用电源的a极为负极 | |
| D. | K与M相接时,阳极附近的pH逐渐增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com