
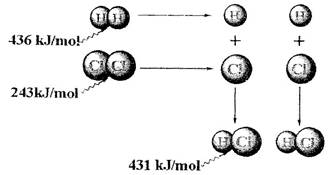
| A£®ĒāĘųÓėĀČĘų·“Ӧɜ³É1 molĀČ»ÆĒāĘųĢ壬·“Ó¦ĪüŹÕ248 kJµÄÄÜĮæ |
| B£®436 kJ/molŹĒÖø¶ĻæŖ1 mol H2ÖŠµÄH£H¼üŠčŅŖ·Å³ö436 kJµÄÄÜĮæ |
| C£®ĒāĘųÓėĀČĘų·“Ӧɜ³É2 molĀČ»ÆĒāĘųĢ壬·“Ó¦·Å³ö183 kJµÄÄÜĮæ |
| D£®431kJ/molŹĒÖøÉś³É2 mol HClÖŠµÄH£Cl¼üŠčŅŖ·Å³ö431 kJµÄÄÜĮæ |
 ÅąÓÅæŚĖćĢāæØĻµĮŠ“š°ø
ÅąÓÅæŚĖćĢāæØĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗŹµŃéĢā
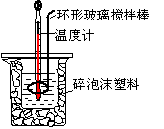
| | ĘšŹ¼ĪĀ¶Čt1/”ę | ÖÕÖ¹ĪĀ¶Č t2/”ę | ĪĀ¶Č²ī (t2£t1) /”ę | ||
| HCl | NaOH | Ę½¾łÖµ | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.5 | 24.50 | 27.5 | 3.00 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā

| A£®N4ŹōÓŚŅ»ÖÖŠĀŠĶ»ÆŗĻĪļ | B£®N4ÓėN2»„ĪŖĶ¬Ī»ĖŲ |
| C£®N4·Šµć±ČP4£Ø°×Į×£©øß | D£®1molN4ĘųĢå×Ŗ±äĪŖN2½«·Å³ö882kJČČĮæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 N2 (g)+ 3H2(g) £Ø”÷H>0£©µÄĘ½ŗā³£ŹżK=2,
N2 (g)+ 3H2(g) £Ø”÷H>0£©µÄĘ½ŗā³£ŹżK=2, 2NH3(g)µÄK= £ØĢīŹżÖµ£©”£
2NH3(g)µÄK= £ØĢīŹżÖµ£©”£ £½H2O£Øl£© ”÷H£½”Ŗ285.8 kJ”¤
£½H2O£Øl£© ”÷H£½”Ŗ285.8 kJ”¤ ”¢Ł
”¢Ł £½NO2£Øg£© ”÷H£½+33.9 kJ”¤
£½NO2£Øg£© ”÷H£½+33.9 kJ”¤ ”¢Ś
”¢Ś  £½NH3£Øg£© ”÷H£½”Ŗ46.0 kJ”¤
£½NH3£Øg£© ”÷H£½”Ŗ46.0 kJ”¤ ”¢Ū
”¢Ū ”¢Ü
”¢Ü²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā

| A£®·“Ó¦¹ż³ĢÖŠÄÜĮæ¹ŲĻµæÉÓĆÉĻĶ¼±ķŹ¾ |
| B£®¦¤HµÄÖµÓė·“Ó¦·½³ĢŹ½µÄ¼ĘĮæĻµŹżÓŠ¹Ų |
| C£®Čō½«øĆ·“Ó¦Éč¼Ę³ÉŌµē³ŲŠæĪŖøŗ¼« |
| D£®Čō½«ĘäÉč¼ĘĪŖŌµē³Ųµ±ÓŠ32.5gŠæČܽāŹ±£¬Õż¼«F·Å³öĘųĢåŅ»¶ØĪŖ11.2L |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®¢Ś¢Ū¢Ü¢Ż¢Ž | B£®¢Ł¢Ś¢Ū¢Ü¢Ż | C£®¢Ś¢Ū¢Ü¢Ż | D£®¢Ś¢Ū¢Ż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Ėį¼īÖŠŗĶ·“Ó¦ | B£®ŅŅ“¼ŌŚæÕĘųÖŠĶźČ«Č¼ÉÕ |
| C£®Šæ·ÅČėĻ”ĮņĖįÖŠ | D£®Ģ¼ŗĶĖ®ÕōĘųŌŚøßĪĀĻĀ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 µÄ¾ų¶ŌÖµ¾łÕżČ·£©£Ø””””£©
µÄ¾ų¶ŌÖµ¾łÕżČ·£©£Ø””””£©| A£®C2H5OH£Øl£©+3O2£Øg£©==2CO2£Øg£©+3H2O£Øg£©£»”÷H="”Ŗ1367.0" kJ/mol£ØČ¼ÉÕČČ£© |
| B£®NaOH£Øaq£©+HCl£Øaq£©==NaCl£Øaq£©+H2O£Øl£©£»”÷H=+57.3kJ/mol£ØÖŠŗĶČČ£© |
| C£®S£Øs£©+O2£Øg£©===SO2£Øg£©£»”÷H=”Ŗ269.8kJ/mol£Ø·“Ó¦ČČ£© |
| D£®2NO2==O2+2NO£»”÷H=+116.2kJ/mol£Ø·“Ó¦ČČ£© |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com