
| X | Y | ||
| Z | W | ||
| T |
| A. | W、Z、T元素的原子半径及它们的最高价氧化的水化物的酸性均依次递增 | |
| B. | X、Y在自然界中都存在多种同素异形体,其氢化物的沸点一定是后者高 | |
| C. | ZY2、WY2可以形成同种类型的晶体,它们都有杀菌消毒的作用 | |
| D. | 根据元素周期律,可以推测Y、Z、T元素的单质与H2化合时的△H逐渐减少 |
分析 X、Y、Z、W为短周期元素,则X、Y为第二周期元素,Z、W为第三周期元素,Z元素的质子数等于X元素最外层电子数的4倍,设X的原子序数为x,则10+x+2=4x,解得x=4,即X为C,Y为O,Z为S,W为Cl,T为Se,然后结合元素周期律及元素化合物知识来解答.
解答 解:X、Y、Z、W为短周期元素,则X、Y为第二周期元素,Z、W为第三周期元素,Z元素的质子数等于X元素最外层电子数的4倍,设X的原子序数为x,则10+x+2=4x,解得x=4,即X为C,Y为O,Z为S,W为Cl,T为Se,
A.原子半径为T>Z>W,最高价氧化的水化物的酸性为W>Z>T,故A错误;
B.C存在金刚石、石墨等同素异形体,O存在氧气、臭氧同素异形体,水中虽含氢键,但C的氢化物不确定,不能比较沸点,故B错误;
C.SO2、ClO2可以形成分子晶体,都有杀菌消毒的作用,故C正确;
D.非金属性越强,与氢气化合放出能量越多,则Y、Z、T元素的单质与H2化合时的△H逐渐增大,故D错误;
故选C.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、原子序数的关系推断元素为解答该题的关键,侧重分析与推断能力的考查,注意元素周期律及元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 由苯与氢气生成环己烷;由乙烯制一氯乙烷 | |
| B. | 乙醇与乙酸制取乙酸乙酯;油脂的皂化反应 | |
| C. | 乙烯与氧气制环氧乙烷;乙醇制乙醛 | |
| D. | 甲苯能使酸性高锰酸钾溶液褪色;丙烯酸使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | A中试剂 | B中试剂 | C中液体 |
| I | 饱和食盐水 | 电石 | H2O |
| II | 浓氨水 | NaOH固体 | CCl4 |
| III | 生铁 | H2O | |
| IV | NaOH溶液 | 镁铝合金 | H2O |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在浓海水中存在反应 Br2+H2O?HBr+HBrO | |
| B. | 纯碱溶液显碱性的原因是 CO32-+2H2O?H2CO3+OH- | |
| C. | 海水中提取溴还可用到的反应 Cl2+2Br-═2Cl-+Br2 | |
| D. | 纯碱吸收溴的主要反应是3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象 | 结论 | |
| A | SO2通入溴水中 | 溴水褪色 | SO2具有漂白性 |
| B | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 | 溶液变成黄色 | 氧化性:H2O2>Fe2+ |
| C | 将溴乙烷与NaOH的乙醇溶液共热,将生成的气体直接通入KMnO4酸性溶液中 | KMnO4酸性溶液褪色 | 乙烯使KMnO4酸性溶液褪色 |
| D | 向a、b两支盛有KI3溶液的试管中分别加入淀粉溶液、硝酸银溶液. | a试管中溶液变蓝 b试管中产生黄色沉淀 | KI3溶液中存在平衡I3--?I2+I- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
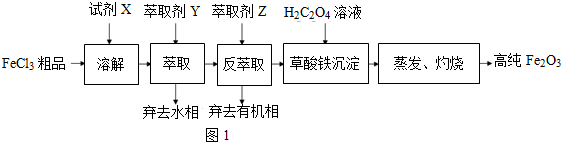
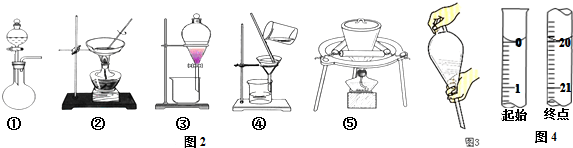
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的分离提纯方法之一为“筛分”,如:胶体--渗析法提纯,浊液--过滤分离,本质上就是依据所分离粒子的直径大小选择具有合适孔径的“筛子” | |
| B. | 容量瓶、量筒和滴定管上都标有使用温度,容量瓶无“0”刻度,量筒和滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| C. | 工业上电解饱和食盐水时,为了阻止产物相互之间反应,往往用阴离子交换膜把阳极和阴极隔开 | |
| D. | 室温下,浓度均为0.1 mol•L-1Na2S2O3和H2SO4溶液,各取5 mL、10 mL的Na2S2O3溶液分别与10 mL的H2SO4溶液混合反应,可验证Na2S2O3浓度对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研发光电转换材料,充分利用太阳能 | |
| B. | 包装材料聚氯乙烯属于烃,会造成环境污染 | |
| C. | 用石灰对煤燃烧形成的烟气脱硫,并回收石膏 | |
| D. | 研发高效生物生长调节剂,减少对化肥的使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com