
| A. | 工业盐可代替食盐食用 | B. | 加碘食盐添加的是碘酸钾 | ||
| C. | 食盐是侯氏制碱的主要原料之一 | D. | 工业上电解饱和食盐水可制取烧碱 |
分析 A.根据工业用盐的成分和亚硝酸盐的毒性判断;
B.加碘食盐中加入的是碘酸钾;
C.依据侯氏制碱法原理解答;
D.电解氯化钠溶液生成氢氧化钠、氢气和氯气.
解答 解:A.工业用盐中有亚硝酸钠,亚硝酸钠有毒,不能代替食用盐,故A错误;
B.加碘食盐中加入的是碘酸钾,故B正确;
C.侯氏制碱法原理:向饱和食盐水中通入氨气再通入二氧化碳即可生成碳酸氢钠固体,碳酸氢钠受热分解即可得到碳酸钠,所以食盐是主要原料之一,故C正确;
D.电解氯化钠溶液生成氢氧化钠、氢气和氯气,工业上电解饱和食盐水可制取烧碱,故D正确;
故选:A.
点评 本题考查了物质的性质和用途,熟悉食盐的成分及性质是解题关键,注意加碘盐成分,题目难度不大.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳碳双键不可旋转所以烯烃一定有顺反异构 | |
| B. | 由乙烯、乙炔的结构特点可推知CH3-CH=C(CH3)-C≡C-CH3分子中所有的碳原子共面 | |
| C. | 甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同 | |
| D. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有乙烯分子中类似的碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
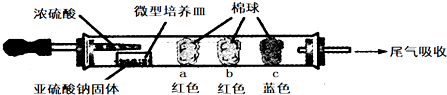
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 品红试液 | 棉球变白,微热后又恢复红色 | |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: 2OHˉ+SO2=SO32ˉ+H2O 或OHˉ+SO2=HSO3ˉ |
| c | 含淀粉的碘水 | 棉球变为白色 | 结论:该气体具有还原 性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCO(g)完全燃烧生成CO2(g)放出热量283J | |
| B. | 1molCO(g)完全燃烧比1molC(s)完全燃烧放出的热量多 | |
| C. | 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2 (g)△H<-452kJ/mol | |
| D. | 当Na2O2(s)与CO2(g)反应生成Na2CO3(s)和O2 (g)放出452kJ热量时,转移的电子数为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 海洋中的珊瑚虫经如下反应形成石灰石外壳,进而形成珊瑚:Ca2++2HCO3-?CaCO3+H2O+CO2.与珊瑚虫共生的藻类会消耗海洋中的CO2.气候变暖、温室效应的加剧干扰了珊瑚虫的生长,甚至致其死亡.下列说法不合理的是( )
海洋中的珊瑚虫经如下反应形成石灰石外壳,进而形成珊瑚:Ca2++2HCO3-?CaCO3+H2O+CO2.与珊瑚虫共生的藻类会消耗海洋中的CO2.气候变暖、温室效应的加剧干扰了珊瑚虫的生长,甚至致其死亡.下列说法不合理的是( )| A. | 共生藻类消耗CO2,有利于珊瑚的形成 | |
| B. | 海洋中CO2浓度升高,抑制了珊瑚的形成 | |
| C. | 温度升高会增大CO2在海水中的溶解度,抑制了珊瑚的形成 | |
| D. | 将CO2转化为甲醇等化工原料,有助于缓解温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PbCO3 | B. | 2PbCO3•Pb(OH)2 | C. | Pb(OH)2 | D. | (CH3COO)2Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
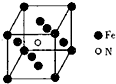 氮、硫、氯、钠、铝、铁及其化合物是研究基本概念和基本理论的重要载体.
氮、硫、氯、钠、铝、铁及其化合物是研究基本概念和基本理论的重要载体.| 性质 | 第一电离能 | 熔点 | 半径 | 键能 |
| 对象 | S<Cl | Na<Al | N3->Al3+ | N=N<N≡N |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com