
某温度下,对于反应N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是( )
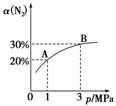
A.将1 mol N2、3 mol H2置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
B.平衡状态由A变到B时,平衡常数K(A)<K(B)
C.上述反应在达到平衡后,增大压强(减小体积),H2的转化率增大
D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子的物质的量为
( )
A.0.1 mol B.0.2 mol C.0.3 mol D.0.4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如右图,下列说法不正确的是( )。
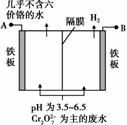
A.A接电源正极
B.阳极区溶液中发生的氧化还原反应为Cr2O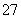 +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
C.阴极区附近溶液pH降低
D.若不考虑气体的溶解,当收集到H2 13.44 L(标准状况)时,有0.1 mol Cr2O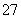 被还原
被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
20 mL 0.1 mol·L-1溶液中含有Fe2+,向其中滴加NaOH溶液至pH=4,溶液中有沉淀生成,过滤,得沉淀和滤液。已知:Ksp[FeOH)3]=4.0×10-38,Ksp[FeOH)2]=8.0×10-16。下列说法不正确的是 )。
A.沉淀只有FeOH)3
B.沉淀有FeOH)3和FeOH)2
C.滤液cFe3+)=4.0×10-8 mol·L-1
D.向滤液中滴加FeCl2溶液,无沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应①:CO(g)+CuO(s)CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1=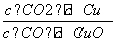
B.反应③的平衡常数K=K1/K2
C.对于反应③,恒容时,若温度升高,H2的浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容时,若增大压强,H2的浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
2NO(g) +O2(g)2NO2(g) 。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图)。
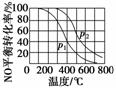
①比较p1、p2的大小关系________。
②随温度升高,该反应平衡常数变化的趋势是________。
(2)[2014·广东理综,31(2)(3)(4)]用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
① 1/4CaSO4(s)+CO(g)1/4CaS(s)+CO2(g) ΔH1=-47.3 kJ·mol-1
② CaSO4(s)+CO(g)CaO(s)+CO2(g) +SO2(g) ΔH2=+210.5 kJ·mol-1
③ CO(g)1/2C(s)+1/2CO2(g) ΔH3=-86.2 kJ·mol-1
①反应①~③的平衡常数的对数lgK随反应温度T的变化曲线见下图,结合各反应的ΔH,归纳lgK~T曲线变化规律:

a.__________________________________________________________;
b.__________________________________________________________。
②向盛有CaSO4的真空恒容密闭容器中充入CO,反应①于900 ℃达到平衡,c平衡(CO)=8.0×10-5 mol·L-1,计算CO的转化率(忽略副反应,结果保留两位有效数字)。
③为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入________。
查看答案和解析>>
科目:高中化学 来源: 题型:
美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁-过氧化氢燃料电池系统。其工作原理如图所示。以下说法中 错误的是( )
错误的是( )

A.电池的负极反应为:Mg-2e-====Mg2+
B.电池工作时,H+向负极移动
C.电池工作一段时间后,溶液的pH增大
D.电池总反应式是:Mg+H2O2+2H+====Mg2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的铁粉中加入稀硝酸,充分反应后,滴入KSCN溶液 | 溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
| B | AgI沉淀中滴入稀的KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| C | 铝箔插入稀硝酸中 | 无现象 | 铝箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
柠檬中含有大量的柠檬酸,因此被誉为“柠檬酸仓库”。柠檬酸的结构简式为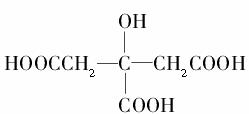 ,则1 mol柠檬酸与足量的金属钠反应,最多可消耗Na的物质的量为( )
,则1 mol柠檬酸与足量的金属钠反应,最多可消耗Na的物质的量为( )
A.2 mol B.3 mol
C.4 mol D.5 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com