
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
i CO2(g)+ 3H2(g) ![]() CH3OH(g)+ H2O(g) H1=Q kJ·mol-1
CH3OH(g)+ H2O(g) H1=Q kJ·mol-1
ii. CO2(g)+ H2(g) ![]() CO(g)+H2O(g) H2=+41 kJ·mol-1
CO(g)+H2O(g) H2=+41 kJ·mol-1
iii. CO(g)+2H2(g) ![]() CH3OH(g) H3= 99 kJ·mol-1
CH3OH(g) H3= 99 kJ·mol-1
回答下列问题:
(1)Q=_________
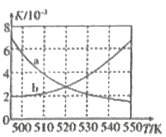
(2)图中能正确反映平衡常数K3(反应iii的平衡常数)随温度变化关系的曲线为__(填字母)
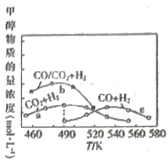
(3)如图为单位时间内CO2+H2、CO+ H2、CO/CO2+H2三个条件下生成甲醇的物质的量浓度与温度的关系(三个条件下通入的CO、CO2和H2的物质的量浓度相同)。490K时,根据曲线a、c判断合成甲醇时主要发生的反应为________(填“i”或“iii”);由曲线a可知,甲醇的量先增大后减小,其原因是_________________________________。
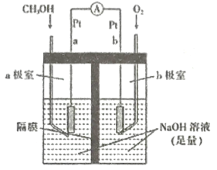
(4)如图是以NaOH溶液为电解质溶液的甲醇燃料电池:电极a的反应式为____________,若隔膜为阳离子交换膜,则每转移6mol电子,溶液中有_______mol Na+向____________(填“正极区”或“负极区")移动。
(5)CO2经催化加氢也可以生成低碳烃,主要有两个竞争反应:
反应I:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
反应II :2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
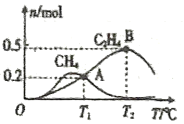
在1L恒容密闭容器中充入2molCO2和4molH2测得平衡时有关物质的物质的量随温度变化如图所示。T1℃时,CO2的转化率为______。T1℃时,反应I的平衡常数K=_________(保留三位有效数字)。
【答案】58 a i 温度低于490K时单位时间内反应未达到平衡,温度升高速率加快,甲醇物质的量增多,温度高于490K时单位时间内反应达到平衡,反应i为放热反应,升高温度平衡左移,甲醇物质的量减少 CH3OH 6e- + 8OH- = CO32 +6H2O 6 正极区 30% 0.0129 L2mol 2
【解析】
⑴根据盖斯定律第二个方程式加第三个方程式得到第一个方程式。
⑵反应iii是放热反应,升高温度,平衡逆向移动,平衡常数减小。
⑶ 490K时,根据图像主要是发生曲线a反应;甲醇的量先增大后减小,其原因是温度低于490K时单位时间内反应未达到平衡,温度升高速率加快,甲醇物质的量增多,温度高于490K时单位时间内反应达到平衡,反应i为放热反应,升高温度平衡左移,甲醇物质的量减少。
⑷甲醇燃料电池中燃料作负极,氧化剂作正极,每转移6mol电子,b极时有6mol OH-生成,根据原电池“同性相吸”原理。
⑸T1℃时,计算生成CH4、C2H4物质的量,根据方程式计算生成CH4、C2H4消耗CO2的物质的量,再计算总消耗CO2的物质的量,再计算CO2的转化率;T1℃时,先计算反应I生成CH4、H2O的物质的量,再计算消耗的CO2和H2的物质的量,再计算反应II生成C2H4、H2O的物质的量,再计算消耗的CO2、H2的物质的量,平衡时还剩余CO2、H2的物质的量,共生成H2O的物质的量,再求反应I的平衡常数。
⑴根据盖斯定律第二个方程式加第三个方程式得到第一个方程式,即H1 =+41 kJ·mol1+ ( 99 kJ·mol1) =58 kJ·mol1;故答案为:58。
⑵反应iii是放热反应,升高温度,平衡逆向移动,平衡常数减小,因此图中能正确反映平衡常数K3(的平衡常数)随温度变化关系的曲线为a;故答案为:a。
⑶ 490K时,根据图像主要是发生曲线a反应,因此合成甲醇时主要发生的反应为i;由曲线a可知,甲醇的量先增大后减小,其原因是温度低于490K时单位时间内反应未达到平衡,温度升高速率加快,甲醇物质的量增多,温度高于490K时单位时间内反应达到平衡,反应i为放热反应,升高温度平衡左移,甲醇物质的量减少;故答案为:i;温度低于490K时单位时间内反应未达到平衡,温度升高速率加快,甲醇物质的量增多,温度高于490K时单位时间内反应达到平衡,反应i为放热反应,升高温度平衡左移,甲醇物质的量减少。
⑷甲醇燃料电池中燃料作负极,氧化剂作正极,因此电极a的反应为CH3OH失去电子,在氢氧化钠作用下生成碳酸根,其反应式为CH3OH 6e- + 8OH- = CO32 +6H2O,若隔膜为阳离子交换膜,则每转移6mol电子,b极时有6mol OH-生成,根据原电池“同性相吸”原理,因此溶液中有6 mol Na+向正极区移动;故答案为:CH3OH 6e- + 8OH- = CO32 +6H2O;6;正极区。
⑸T1℃时,生成CH4物质的量为0.2mol,生成C2H4物质的量为0.2mol,根据方程式生成0.2mol CH4,则消耗CO2物质的量为0.2mol,生成0.2mol C2H4,则消耗CO2物质的量为0.4mol,共消耗CO2物质的量为0.6mol,因此CO2的转化率为![]() ;T1℃时,反应I生成0.2mol CH4,0.4mol H2O,消耗0.2mol CO2,0.8mol H2,反应II生成0.2mol C2H4,0.8mol H2O,消耗0.4mol CO2,1.2mol H2,平衡时还剩余1.4mol CO2,2mol H2,共生成1.2mol H2O,因此反应I的平衡常数
;T1℃时,反应I生成0.2mol CH4,0.4mol H2O,消耗0.2mol CO2,0.8mol H2,反应II生成0.2mol C2H4,0.8mol H2O,消耗0.4mol CO2,1.2mol H2,平衡时还剩余1.4mol CO2,2mol H2,共生成1.2mol H2O,因此反应I的平衡常数 ;故答案为:30%;0.0129 L2mol 2。
;故答案为:30%;0.0129 L2mol 2。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述错误的是( )
A.丙烷的一氯代物有 2 种,丙烷的二氯代物有 4 种
B.分子式为 C7H8O 且属于芳香族化合物的同分异构体有 5 种
C.联苯![]() 的一氯代物有 3 种,二氯代物有 12 种
的一氯代物有 3 种,二氯代物有 12 种
D.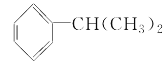 与 Cl2 在光照条件下的取代产物有 3 种
与 Cl2 在光照条件下的取代产物有 3 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为__、__(填标号)。
A.
B.
C.
D.
(2)Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究SO2与Cu(OH)2悬浊液的反应。
(1)实验一:用如图装置(夹持装置已略,气密性已检验)制备SO2,将SO2通入Cu(OH)2悬浊液的反应中。B中出现少量红色沉淀;稍后,B中所得溶液呈绿色,与CuSO4溶液、CuCl2溶液的颜色有明显不同。
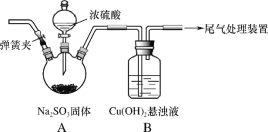
①排除装置中的空气,避免空气对反应干扰的操作是_____,关闭弹簧夹。
②打开分液漏斗旋塞,A中发生反应的方程式是_____。
(2)实验二:为确定红色固体成分,进行以下实验:
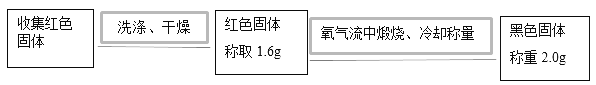
①在氧气流中煅烧红色固体的目的是_____。
②根据上述实验可得结论:该红色固体为_____。
(3)实验三:为探究B中溶液呈绿色而不是蓝色的原因,实验如下:
i.向4mL1mol/L的CuSO4溶液中通入过量SO2,未见溶液颜色发生变化。
ii.取少量B中滤液,加入少量稀盐酸,产生无色刺激性气味的气体,得到澄清的蓝色溶液。再加入BaCl2溶液,出现白色沉淀。
查阅资料:SO2在酸性条件下还原性较差。
①实验i的目的_____。
②根据上述实验可得结论:溶液显绿色的原因是溶液中含有较多Cu(HSO3)2。小组同学通过进一步实验确认了这种可能性,在少量1mol/L的CuSO4溶液中加入_____溶液,得到绿色溶液。
(4)综上实验可以得出:出现红色沉淀的原因是:_____;(用离子方程式表示)溶液呈现绿色的原因是:_____。(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336 mL(标准状况)气体。回答:
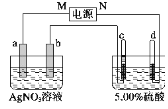
(1)直流电源中,M为_________极。
(2)Pt电极上生成的物质是_________,其质量为___________g。
(3)AgNO3溶液的浓度______填“增大”、“减小”或“不变”,下同),AgNO3溶液的pH_________,硫酸的浓度________, 硫酸的pH_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大功率Al-H2O2动力电池(如图),下列说法不正确的是
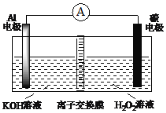
A. H2O2 在碳电极上发生还原反应
B. 碳电极附近溶液的pH增大
C. 溶液中OH-向负极移动
D. 负极反应式为Al-3e-+3OH-=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图中的实验方案,不能达到实验目的的是( )
A.依据2Fe3+(aq)+Cu(s)=Cu2+(aq)+2Fe2+(aq)设计如图甲装置的原电池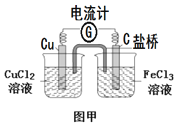
B.利用图乙装置验证氯化钠溶液(含酚酞)电解产物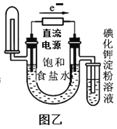
C.利用图丙装置测定中和热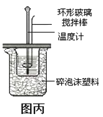
D.利用图丁装置探究浓度对化学反应速率的影响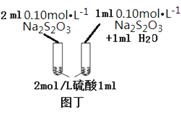
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲元素原子的L电子层上只有一个空原子轨道;乙元素原子的核电荷数为33。根据甲、乙两元素的信息,回答有关问题:
(1)甲的元素符号是____________;其轨道表示式为____________。
(2)乙元素原子的最外层电子排布式为____________,其在元素周期表中的位置是____________。
(3)甲属于____________区元素,乙属于____________区元素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有0.01molFeCl3的氯化铁饱和溶液因久置变得浑浊,将所得分散系从如图所示装置的 A 区流向B区,其中C区是不断更换中的蒸馏水。已知NA为阿伏加德罗常数的值。下列说法不正确的是
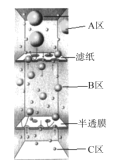
A.实验室制备 Fe(OH)3胶体的反应为:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
B.滤纸上残留的红褐色物质为Fe(OH)3固体颗粒
C.在B区的深红褐色分散系为Fe(OH)3胶体
D.进入C区的H+的数目为0.03NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com