
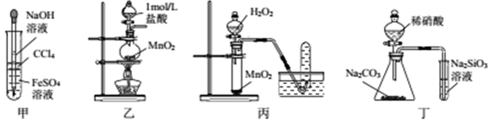
| A. | 用甲所示装置制取并观察Fe(OH)2 | |
| B. | 用乙所示装置制取少量Cl2 | |
| C. | 用丙所示装置制取O2 | |
| D. | 用丁所示装置比较N、C、Si的非金属性强弱 |
分析 A.四氯化碳密度比水大,在溶液下层;
B.稀盐酸与二氧化锰不反应;
C.过氧化氢在二氧化锰催化下分解生成氧气;
D.硝酸易挥发,生成的二氧化碳中混有硝酸.
解答 解:A.四氯化碳密度比水大,在溶液下层,实验应用苯或煤油等,故A错误;
B.稀盐酸还原性较弱,与二氧化锰不反应,应用浓盐酸,故B错误;
C.过氧化氢在二氧化锰催化下分解生成氧气,且氧气不溶于水,可用偏排水法收集,故C正确;
D.硝酸易挥发,生成的二氧化碳中混有硝酸,不能比较碳酸、硅酸的酸性,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的制备、气体的收集以及性质的比较等,把握实验原理及实验装置图的作用为解答的关键,注意方案的合理性、操作性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 100g质量分数为46%的乙醇溶液中所含的氢原子数为12NA | |
| B. | pH=1的硫酸溶液中含有的SO42-数目为0.05NA | |
| C. | 向1L0.3mol•L-1NaOH溶液中通入0.2molCO2,溶液中CO32-和HCO3-的数目均为0.1NA | |
| D. | 0.2molNH3与0.3molO2在催化剂的作用下加热充分反应,所得NO的分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)=0.1 mo1•L-1 | B. | c(CO32-)>c(OH-) | ||
| C. | c(HCO3-)>c(CO32-) | D. | c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCO3可以除去MgCl2酸性溶液中的Fe3+ | |
| B. | 实验测得NaHSO3溶液的pH<7,说明则H2SO3是强酸 | |
| C. | 通过化学变化可以“点石成金”,即可将黏土转化成金单质 | |
| D. | 2.24LNO与1.12O2充分反应所得气体中原子数目一定为0.3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu与浓硝酸反应制备NO2:3Cu+8H++2NO3-═3Cu2++2NO2↑+4H2O | |
| B. | Na2S2O3溶液吸收水中多余的Cl2:4Cl2+S2O32-+5H2O=10H++2SO42-+8Cl- | |
| C. | 用惰性电极电解CuSO4溶液:2Cu2++4OH-$\frac{\underline{\;通电\;}}{\;}$2Cu↓+O2↑+2H2O | |
| D. | 向明矾溶液中滴入氢氧化钡溶液至沉淀的物质的量最大:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱石灰具有吸水性,可用于干燥氯气 | |
| B. | 甲醛能使蛋白质变性,可以用于食品防腐剂 | |
| C. | 炭具有强还原性,常用于冶炼钠、钾等金属 | |
| D. | 碳酸氢钠溶液具有弱碱性,可用于制胃酸中和剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作与现象 | 结论 |
| A | 将Fe(NO3)2溶于稀H2SO4后,滴加KSCN溶液, 溶液变成红色 | Fe(NO3)2中一定含Fe3+ |
| B | 从煤油中取出一小块钠,用滤纸擦净表面的煤油, 放入无水乙醇中,产生气泡 | Na能置换出醇烃基中的氢 |
| C | 将某气体通入品红溶液,溶液褪色 | 气体一定是SO2 |
| D | 向NaAlO2溶液中滴入NaHCO3溶液,产生白色沉淀 | AlO2-结合H+的能力比CO32-强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
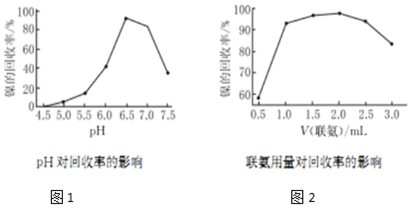
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com