
氢气是清洁的能源,也是重要的化工原料。
(1)以H2为原料制取氨气进而合成CO(NH2)2的反应如下:
N2(g)+3H2(g)=2NH3(g) △H=―92.40 kJ·mol-1
2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=―159.47 kJ·mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) △H=+72.49 kJ·mol-1
则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为 。
(2)用丙烷和水为原料在电催化下制氢气,同时得到一种含有三元环的环氧化合物A,该反应的化学方程式为 。该反应也可生成A的同分异构体——另一种环氧化合物B,B的核磁共振氢谱为下图中的 (填“a”或“b”)。

(3)已知叠氮酸(HN3)不稳定,同时也能与活泼金属反应,反应方程式为:
2HN3=3N2↑+H2↑
2HN3+Zn=Zn(N3)2+H2↑
2 mol HN3与一定量Zn完全反应,在标准状况下生成67.2 L气体,其中N2的物质的量为 。
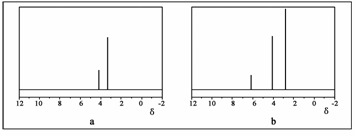
(4)已知H2S高温热分解制H2的反应为:H2S(g) H2(g)+1/2S2(g) 在恒容密闭容器中,控制不同温度进行H2S的分解实验:以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(H2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。
H2(g)+1/2S2(g) 在恒容密闭容器中,控制不同温度进行H2S的分解实验:以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(H2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。

(5)用惰性电极电解煤浆液的方法制H2的反应为:C(s)+2H2O(l)=CO2(g)+2H2(g)现将一定量的1 mol·L-1 H2SO4溶液和适量煤粉充分混合,制成含碳量为0.02 g·mL-1~0.12g·mL-1的煤浆液,置于右图所示装置中进行电解(两电极均为惰性电极)。则A极的电极反应式为 。

(1)N2(g)+3H2(g)+CO2(g)=CO(NH2)2(s)+H2O(l) △H=-179.38 kJ·mol-1(2分)
(2)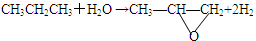 (反应条件可写也可不写)(2分) a(2分)
(反应条件可写也可不写)(2分) a(2分)
(3)2 mol(2分)
(4)0.4c/t mol·L-1·min-1(2分)(单位不写扣1分)
温度升高,反应速率加快,达到平衡所需的时间缩短(合理答案均可)(2分)
(5)C+2H2O-4e-=CO2↑+4H+(2分)
【解析】
试题分析:(1)3个热化学方程式相加得出N2(g)+3H2(g)+CO2(g)=CO(NH2)2(s)+H2O(l) △H=-179.38 kJ·mol-1,(2)三元环的环氧化合物应为2个碳原子1个氧原子的环;另一种环氧化合物应为四元环醚, ,图谱为a;(3)根据产生气体的量确定HN3发生两个反应,设两个反应中的量分别为
,图谱为a;(3)根据产生气体的量确定HN3发生两个反应,设两个反应中的量分别为
(3)x、y,有x+y=2 2x+1/2y=67.2÷22.4,解得x=4/3、y=2/3,产生氮气的量为4/3×3/2=2mol;
(4)反应经t min达到平衡,此时H2S的转化率为40%,反应中变化的浓度为0.4cmol·L-1,氢气与H2S变化相同v(H2)=0.4c/t mol·L-1·min-1;温度升高,反应速率加快,达到平衡所需的时间缩短;(5)A电极为阳极,碳失去电子生成二氧化碳,C+2H2O-4e-=CO2↑+4H+。
考点:考查化学反应原理有关问题。


科目:高中化学 来源: 题型:
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
阅读下列短文,完成以下4题
英国国家海洋学中心于2009年8月14日发布新闻公报说,中心的研究人员及其同行利用声呐等手段探测到北极海洋中存在大量甲烷气泡,证实了全球变暖会使海底释放大量甲烷的说法。研究人员认为,这些甲烷可能会反过来加剧全球变暖。
(1)已知天然气的主要成分CH4是一种会产生温室效应的气体,等物质的量的CH4和CO2产生的温室效应,前者大。下面是有关天然气的几种叙述,其中正确的是( )
①天然气与煤、柴油相比是较清洁的能源;②等质量的CH4和CO2产生的温室效应也是前者大;③燃烧天然气也是酸雨的成因之一
A.①②③ B.只有① C.①和② D.只有③
(2)可燃冰又称天然气水合物,它是海底的高压、低温条件下形成的,外观像冰。其化学式为8CH4·46H2O,1体积可燃冰可贮载100~200体积的天然气。下面关于可燃冰的叙述不正确的是( )
A.可燃冰有可能成为人类未来的重要能源
B.可燃冰是一种比较洁净的能源
C.可燃冰提供了水可能变成油的例证
D.可燃冰的主要可燃成分是甲烷
(3)下列事实、事件、事故中与甲烷无关的是( )
A.天然气的主要成分
B.造成“光化学烟雾”的气体
C.“西气东输”工程
D.煤矿中的瓦斯爆炸
(4)下列叙述中正确的是( )
A.在通常情况下,甲烷与高锰酸钾等强氧化剂不反应,与强酸、强碱也不反应
B.甲烷燃烧能放出大量的热,所以它是一种很好的气体燃料,但点燃甲烷不必像点燃氢气那样事先验纯
C.甲烷分子是空间正方体结构,甲烷分子中4个碳氢键是完全等同的
D.1 mol CH4与4mol Cl2发生取代反应后,测得四种有机取代物的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
氢气是清洁的能源,也是重要的化工原料。
(1)以H2为原料制取氨气进而合成CO(NH2)2的反应如下:
N2(g)+3H2(g)=2NH3(g) △H=―92.40 kJ·mol-1
2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=―159.47 kJ·mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) △H=+72.49 kJ·mol-1
则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为 ▲ 。
(2)用丙烷和水为原料在电催化下制氢气,同时得到一种含有三元环的环氧化合物A,该反应的化学方程式为 ▲ 。
该反应也可生成A的同分异构体——另一种环氧化合物B,B的核磁共振氢谱为
下图中的 ▲ (填“a”或“b”)。
(3)已知叠氮酸(HN3)不稳定,同时也能与活泼金属反应,反应方程式为:
2HN3=3N2↑+H2↑
2HN3+Zn=Zn(N3)2+H2↑
2 mol HN3与一定量Zn完全反应,在标准状况下生成67.2 L气体,其中N2的物质的量为 ▲ 。
(4)已知H2S高温热分解制H2的反应为:
H2S(g)![]() H2(g)+1/2S2(g)
H2(g)+1/2S2(g)
在恒容密闭容器中,控制不同温度进行H2S的分解实验:
以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中
 a为H2S的平衡转化率与温度关系
a为H2S的平衡转化率与温度关系
曲线,b曲线表示不同温度下反应
经过相同时间且未达到化学平衡时
H2S的转化率。
若985℃时,反应经t min达到平衡,
此时H2S的转化率为40%,则反应
速率v(H2)= ▲ (用含c、t的代
数式表示)。
请说明随温度的升高,曲线b向曲线a逼近的原因: ▲ 。
 (5)用惰性电极电解煤浆液的方法制H2的反应为:
(5)用惰性电极电解煤浆液的方法制H2的反应为:
C(s)+2H2O(l)=CO2(g)+2H2(g)
现将一定量的1 mol·L-1 H2SO4溶液和适量煤
粉充分混合,制成含碳量为0.02 g·mL-1~0.12
g·mL-1的煤浆液,置于右图所示装置中进行电
解(两电极均为惰性电极)。则A极的电极
反应式为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
阅读下列短文,完成以下4题
英国国家海洋学中心于2009年8月14日发![]() 布新闻公报说,中心的研究人员及其同行利用声呐等手段探测到北极海洋中存在大量甲烷气泡,证实了全球变暖会使海底释放大量甲烷的说法。研究人员认为,这些甲烷可能会反过来加剧全球变暖。
布新闻公报说,中心的研究人员及其同行利用声呐等手段探测到北极海洋中存在大量甲烷气泡,证实了全球变暖会使海底释放大量甲烷的说法。研究人员认为,这些甲烷可能会反过来加剧全球变暖。
(1)已知天然气的主要成分CH4是一种会产生温室效![]() 应的气体,等物质的量的CH4和CO2产生的温室效应,前者大。下面是有关天然气的几种叙述,其中正确的是( )
应的气体,等物质的量的CH4和CO2产生的温室效应,前者大。下面是有关天然气的几种叙述,其中正确的是( )
①天然气与煤、柴油相比是较清洁的能源;
②等质量的CH4和CO2产生的温室效应也是前者大;
③燃烧天然气也是酸雨的成因之一
A.①②③ B.只有① C.①和② D.只有③
(2)可燃冰又称天然气水合物,它是海底的高压、低温条件下形成的,外观像冰。其化学式为8CH4·46H2O,1体积可燃冰可贮载100~200体积的天然气。下面关于可燃冰的叙述不正确的是( )
A.可燃冰有可能成为人类未来的重要能源
B.可燃冰是一种比较洁净的能源
C.可燃冰提供了水可能变成油的例证
D.可燃冰的主要可燃成分是甲烷
(3)下列事实、事件、事故中与甲烷无关的是( )
A.天然气的主要成分
B.造成“光化学烟雾”的气体]
C.“西气东输”工程
D.煤矿中的瓦斯爆炸
(4)下列叙述中正确的是( )
A.在通常情况下,甲烷与高锰酸钾等强氧化剂不反应,与强酸、强碱也不反应
B.甲烷燃烧能放出大量的热,所以它是一种很好的气体燃料,但点燃甲烷不必像点燃氢气那样事先验纯
C.甲烷分子是空间正方体结构,甲烷分子中4个碳氢键是完全等同的
D.1 mol CH4与4mol Cl2发生取代反应后,测得四种有机取代物的物质的量相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com