
如图所示2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是()

A. 1个乙分子中含有2个A原子
B. 摩尔质量关系为:2M (甲)=M (乙)+M (丙)
C. 该反应一定属于氧化还原反应
D. 该反应类型是分解反应
考点: 阿伏加德罗定律及推论;摩尔质量;氧化还原反应;化学基本反应类型.
分析: 由图示可以推出甲、丙的化学式可分别表示为A3B、B2.根据质量守恒定律化学反应前后原子的个数不变,可知3个乙分子中共含有6个A原子,则乙为单质,化学式可表示为A2,该反应可以表示为2BA3→B2+3A2,化学反应过程中原子种类不发生变化,以此解答该题.
解答: 解:由图示可以推出甲、丙的化学式可分别表示为A3B、B2.根据质量守恒定律化学反应前后原子的个数不变,可知3个乙分子中共含有6个A原子,则乙为单质,化学式可表示为A2,该反应可以表示为2BA3→B2+3A2,
A.由上述分析可知,乙的化学式可表示为A2,1个乙分子中含有2个A原子,故A正确;
B.该反应可以表示为2BA3→B2+3A2,则2Mr(甲)=3Mr(乙)+Mr(丙),故B错误;
D.该反应为分解反应,且有单质生成,A元素化合价一定变化,属于氧化还原反应,故C正确;
D.反应的特点是化合物生成单质,该反应可以表示为2BA3→B2+3A2,为分解反应,故D正确;
故选B.
点评: 本题以微观示意图的形式考查阿伏加德罗定律及氧化还原反应,解题的关键是能够根据微观的分子结构分析物质的组成,然后结合相关的知识逐项分析,注意质量守恒定律和阿伏加德罗定律的区别,题目难度不大.


科目:高中化学 来源: 题型:
1mol白磷转化为红磷时放出18.39kJ热量,已知:P4(白磷,s)+5O2(g)═2P2O5(s)△H=﹣a kJ/mol(a>0);4P(红磷,s)+5O2(g)═2P2O5(s)△H=﹣b kJ/mol(b>0),则a和b的关系是( )
|
| A. | a>b | B. | a=b | C. | a<b | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列溶液中的微粒浓度关系正确的是( )
|
| A. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl﹣)+c(ClO﹣)+c(OH﹣) |
|
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(H2CO3) |
|
| C. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl﹣)=c(NH4+)>c(OH﹣)=c(H+) |
|
| D. | 0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合:2c(H+)﹣2c(OH﹣)=c(CH3COO﹣)﹣c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,有关水溶液的pH说法正确的是 ( )。
A.在pH=12的溶液中,水电离出的c(OH-)一定等于10-2 mol·L-1
B.将pH=2和pH=12的酸碱溶液等体积混合后,溶液的pH一定等于7
C.若强酸、强碱中和后pH=7,则中和之前酸、碱的pH之和为14
D.含等物质的量的HNO3、Na2CO3、CH3COOH的溶液混合后,溶液的pH一定大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
原子结构模型的演变图如图:

其中,(1)为道尔顿实心球式原子模型;(2)为卢瑟福行星运转式原子模型;(3)为汤姆生葡萄干面包式原子模型;(4)为近代量子力学原子模型;(5)为玻尔轨道式原子模型.下列符合历史演变顺序的一组排列是()
A. (1)(3)(2)(5)(4) B. (1)(2)(3)(4)(5) C. (1)(5)(3)(2)(4) D. (1)(3)(5)(4)(2)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是()
A. 将Na2CO3固体加入新制的氯水中,有无色气泡(H+)
B. 向淀粉KI溶液中滴加新制氯水,溶液变蓝(Cl2)
C. 将AgNO3溶液滴加到新制氯水中,有白色沉淀产生(Cl﹣)
D. 新制氯水使红色布条褪色(HCl)
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素的一种核素X的质量数为A,含N个中子,它与1H原子组成HmX分子,在ag HmX中所含质子的物质的量是()
A.  (A﹣N+m)mol B.
(A﹣N+m)mol B. 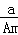 (A﹣N)mol C.
(A﹣N)mol C.  (A﹣N)mol D.
(A﹣N)mol D. 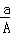 (A﹣N+m)mol
(A﹣N+m)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气中O2的体积百分数。
(1) 实验前用碱液清洗铁钉,再用0.100mol/L的 H2SO4溶液浸泡至有气泡产生。用H2SO4溶液浸泡的目的是______。
(2) 为尽量减小误差,下列操作的正确顺序是______(填序号)。
①装入铁钉
②插入注射器向铁钉表面滴入适量 NaCl溶液并打开止水夹
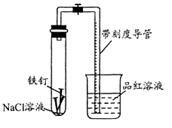 ③将导管口浸入品红溶液
③将导管口浸入品红溶液
④塞上单孔活塞
⑤检查装置气密性
(3) 检查装置气密性的方法:_______________________________。
(4)实验中试管内发生的反应为:____________________________。
用该实验方案测量空气中O2的体积百分数时应测量的数据是:①导管与试管内部空间总体积,
②__________________________________________。
(5) 实验时发现上述测量过程因反应较慢耗时较长,对其影响因素作如下分析:
假设一:电解质溶液的PH 假设二: NaCl溶液的浓度 假设三:铁钉的表面积
(6)借助上述实验装置,通过调节溶液的pH验证假设一,获得了如下实验数据:
①当pH=2时,没有观察到稳定液柱形成的原因是______
②根据实验数据分析,为缩短实验测定时间,pH的最佳范围是______
③按上述实验装置,设计实验证明假设二。
第一步:____________;
第二步: ______,分别用注射器将NaCl溶液滴入铁钉表面;
第三步:记录形成稳定液柱所用时间和液柱的高度,比较分析数据得出结论。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com