
【题目】将两根铁钉分别缠绕铜丝和铝条,放入滴有混合溶液的容器中,如图所示,下列叙述错误的是

A. b中铁钉附近呈现红色 B. a中铁钉附近呈现蓝色沉淀
C. b中发生吸氧腐蚀 D. a中铜丝附近有气泡产生
 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:
【题目】已知:
①CO(g)+![]() O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
②H2(g)+![]() O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
下列说法正确的是( )
A. 通常状况下,氢气的燃烧热为241.8 kJ·mol-1
B. 由①可知,1 mol CO(g)和![]() mol O2(g)反应生成 1 mol CO2(g),放出283.0 kJ的热量
mol O2(g)反应生成 1 mol CO2(g),放出283.0 kJ的热量
C. 可用下图表示2CO2(g)===2CO(g)+O2(g)反应过程中的能量变化关系
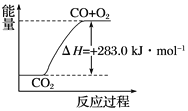
D. 分解1 mol H2O(g),其反应热为-241.8 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下浓度为0.lmol/L的下列溶液的pH如下表,下列有关说法正确的是
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
A. 在相同温度下,同浓度的三种酸溶液的导电能力顺序: H2CO3<HClO<HF
B. 根据上表,水解方程式ClO-+H2O![]() HClO+OH-的水解常数K=10-7.6
HClO+OH-的水解常数K=10-7.6
C. 若将CO2通入0.lmol/LNa2C03溶液中至溶液中性,则溶液中2c(CO32-)+c(HCO3-)=0.1 mol/L
D. 向上述NaC1O溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>(H+)>c(HClO)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. HS-的水解方程式为:HS-+ H2O![]() H3O++S2-
H3O++S2-
B. CH3COOH 溶液加水稀释后,溶液中![]() 的值减小
的值减小
C. 将pH =4的盐酸稀释后,溶液中所有离子的浓度均降低
D. 100℃时,pH=12的纯碱溶液中:c(OH-)=1.0×10-2 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL 0.1mol/LNaOH溶液中加入0.1mol/L的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是( )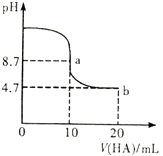
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)=c(A-)+c(HA)
D.b点所示溶液中c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素a、b、c、d、e为前20号主族元素,原子序数依次增大。b元素原子最外层电子数与核外电子总数之比为2:3;c的氢化物能与其最高价氧化物对应的水化物反应生成一种盐;a与b、c均可以形成电子总数为10的分子;d元素的氧化物能使品红溶液褪色,且加热后品红颜色复原;e原子是前20号主族元素中原子半径最大的。请回答:
(1)e元素在周期表中的位置_______________。
(2)bd2的电子式_______________;e2d的电子式_______________;ca3的空间构型_______________。
(3)e的最高价氧化物的水化物所含化学键类型为______________、_______________,晶体类型为_______________。其溶液与b的最高价氧化物反应的离子方程式为____________________________。
(4)在常温常压下,1g b的最简单气态氢化物完全燃烧放出的热量约为56kJ,写出该反应的热化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,正确的是
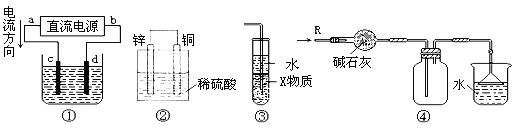
A. 若采用装置①铝件镀银,则c极为铝件,d极为纯银,电解质溶液为AgNO3溶液
B. 装置②是原电池,能将化学能转化为电能,SO42-移向锌电极
C. 装置③中X若为四氯化碳,用于吸收氨气或氯化氢,会引起倒吸
D. 装置④可用于收集氨气,并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以锌片和铜片为电极,以稀硫酸为电解质溶液的原电池中,当导线中通过2mol电子时,下列说法正确的是( )
A.锌片溶解了1mol,铜片上析出1mol氢气
B.锌片发生还原反应
C.正极附近的SO42﹣离子浓度逐渐增大
D.电池工作时,电子由正极通过外电路流向负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2- 等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2 + CO ![]() CO2 + NO 该反应的平衡常数为K1(下同)
CO2 + NO 该反应的平衡常数为K1(下同)
每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式____________________________以及此热化学方程式的平衡常数K=____________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的![]() ,则反应开始到平衡时CO的平均反应速率v(CO)=________。
,则反应开始到平衡时CO的平均反应速率v(CO)=________。
若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围________________。
(3)电化学降解NO2-的原理如下图:
①电源的负极是____________(填A或B)阴极反应式为________________。
②若电解过程中转移了6mol电子,则膜两侧电解液的质量变化差![]() 为_____g。
为_____g。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com