
某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42-.
Ⅰ、某校研究性学习小组设计如图流程以回收铜和硫酸亚铁.请回答:
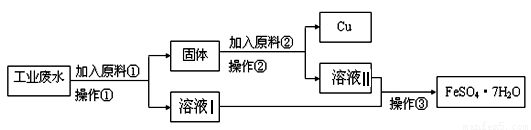
(1)反应①的离子方程式为 。
(2)操作①中用到的玻璃仪器是______ (填序号)。
a.烧杯 b.漏斗 c.玻璃棒 d.酒精灯
(3)固体成份是 (填名称)。
(4)原料②的名称为 。
Ⅱ、回收的铜可用于制备胆矾(CuSO4·5H2O)。,可将铜和一定浓度稀硫酸混合后并在加热的情况下通入氧气,发生如下反应:2Cu+2H2SO4+O2 2CuSO4 + 2H2O。制得硫酸铜溶液后经过蒸发、浓缩,冷却结晶,过滤可得胆矾。
2CuSO4 + 2H2O。制得硫酸铜溶液后经过蒸发、浓缩,冷却结晶,过滤可得胆矾。
①请分析2Cu+2H2SO4+O2 2CuSO4 + 2H2O反应中,氧化剂是 ,还原剂是 (填化学式)。
2CuSO4 + 2H2O反应中,氧化剂是 ,还原剂是 (填化学式)。
②用双线桥标出上述反应的电子得失。2Cu+2H2SO4+O2 2CuSO4 + 2H2O
2CuSO4 + 2H2O
科目:高中化学 来源:2016届福建省四地六校高三上学期第二次联考化学试卷(解析版) 题型:选择题
下列实验“操作和现象”与“结论”都正确的是
操作和现象 | 结论 | |
A | 切开金属钠,钠表面的银白色会逐渐变暗 | Na在空气中会生成Na2O2 |
B | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
C | SO2通入酸性KMnO4溶液,溶液褪色 | SO2具有漂白性 |
D | 将充满NO2的试管倒立在水中,试管内液面约上升至试管容积的2/3处;缓慢通入O2,轻轻晃动试管,至液体基本上充满试管 | 从原料的充分利用和减少污染物的排放等方面考虑,该实验对工业生产硝酸有重要启示 |
查看答案和解析>>
科目:高中化学 来源:2016届湖北省松滋市高三上学期期中测试化学试卷(解析版) 题型:填空题
四川盛产五倍子。以五倍子为原料可以制得化合物A。A的结构简式如下图所示:

请回答下列问题:
(1)A中有哪些官能团(写出名称)_______。
(2)有机物B在硫酸催化条件下加热发生酯化反应可得到A。请写出B的结构简式_________。
(3)1molA最多能消耗 molNaOH;请写出A与过量的NaOH溶液反应的化学方程式________。
(4)有机化合物C是合成治疗禽流感药物的原料之一。C可以看做是B与氢气按物质的量之比1:2发生加成反应得到的产物。C分子中无羟基与碳碳双键直接相连的结构,它能使溴水褪色。请写出C与溴水反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省扶余市高一上学期期中测试化学试卷(解析版) 题型:填空题
对某些化学反应,由于反应物用量不同,产物也会有所不同,试根据溶液中离子反应的初步知识,完成下列情况下的离子方程式。
(1)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,写出发生反应的离子反应方程式 ;
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,写出发生反应的离子方程式 ;
(3)向Ba(OH)2溶液中逐滴加入NaHSO4至恰好完全沉淀,写出反应的离子方程式 ;
(4)在(3)的溶液中,继续滴加NaHSO4溶液,写出发生反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省淄博市高一上学期期中测试化学试卷(解析版) 题型:选择题
小明体检的血液化验单中,葡萄糖为5.9mmol/L.该体检指标的物理量是
A.物质的量浓度 B.溶解度 C.质量分数 D.摩尔质量
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北成安一中、永年二中高二上期中联考化学试卷(解析版) 题型:填空题
将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2 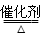 2SO3 ΔH <0。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。请回答下列问题:
2SO3 ΔH <0。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改用效率更高的催化剂 d.升高温度
(3)求该反应达到平衡时SO2的转化率(用百分数表示)为____________。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀___________克?
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二上学期期中(理)化学试卷(解析版) 题型:填空题
在水溶液中橙色的Cr2O72-与黄色的CrO42-存在如下平衡:Cr2O72-+H2O 2CrO42-+2H+,已知重铬酸钾(K2Cr2O7)稀溶液为橙色。取甲、乙两支试管分别加入2mL重铬酸钾稀溶液,进行如下操作:
2CrO42-+2H+,已知重铬酸钾(K2Cr2O7)稀溶液为橙色。取甲、乙两支试管分别加入2mL重铬酸钾稀溶液,进行如下操作:
(1)向甲试管中加入NaOH溶液,上述平衡向方向 移动(填“正反应”或“逆反应”);
(2)向乙试管中加入足量Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),溶液最终显 色。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省襄阳市四校高二上学期期中联考化学试卷(解析版) 题型:选择题
在密闭容器中进行如下反应:X2(g)+Y2(g)? 2Z(g),已知 X2、Y2、Z的起始浓度分别为 0.1 mol•L?1、0.3 mol•L?1、0.2 mol•L?1,在一定的条件下,当反应达到平衡时,各物质的浓度有可能是
A.Z为0.4 mol•L?1 B.Y2为0.4 mol•L?1 C.X2为0.2 mol•L?1 D.Z为0.3 mol•L?1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com